
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
分析 由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答 解:①BeCl2中含有极性键,为直线形分子,结构对称正负电荷重心重叠,为非极性分子,故①正确;
②C2H4属于分子晶体,晶体中含有C-H极性键,结构对称正负电荷重心重叠,为非极性分子,故②正确;
③白磷为单质,分子中只含有非极性键,属于非极性分子,故③错误;
④BF3中含有极性键,为平面三角形分子,正负电荷重心重叠,为非极性分子,故④正确;
⑤NF3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,为极性分子,故⑤错误;
⑥过氧化氢中含有极性键,但氧含有孤对电子,过氧化氢结构不对称,属于极性分子,故⑥错误;
故选C.
点评 本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
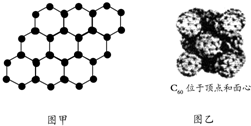
| A. | 60 g SiO2晶体中含有2×6.02×1023个Si-O键 | |
| B. | 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图甲),则0.12 g石墨烯中含有6.02×1022个碳原子 | |
| C. | 720 g C60晶体(如图乙)中含有6.02×1023个晶胞结构单元 | |
| D. | 14 g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
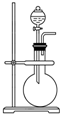 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | 若AB2分子的构型为V型,则A可能为sp2杂化 | |
| D. | H2S和SO2分子中的中心原子杂化类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
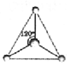 CH3+;
CH3+;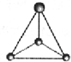 CH3-.
CH3-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炼铁过程中的铁元素 | B. | 炼铁过程中的氧元素 | ||
| C. | 炼铁过程中的碳元素 | D. | 炼钢过程中的铁元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com