
分析 (1)物质的量浓度C=$\frac{1000ρω%}{M}$;
(2)9.36g氯化钠的物质的量n=$\frac{9.36g}{58.5g/mol}$=0.16mol,50g质量分数为98%的浓硫酸中含有的硫酸的物质的量n=$\frac{50g×98%}{98g/mol}$=0.5mol.
在加热条件下,氯化钠和浓硫酸发生反应:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4,故可知浓硫酸过量,应根据氯化钠的物质的量来计算.设生成的HCl的物质的量为xmol,根据化学方程式可知:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4
2 2
0.16mol xmol
故能解得x.
然后根据所得溶液的质量分数=$\frac{{m}_{溶质}}{{m}_{溶质}+{m}_{溶剂}}×100%$来计算.
解答 解:(1)浓硫酸的物质的量浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.84g/mL×98%}{98g/mol}$=18.4mol/L,
答:浓硫酸的浓度为18.4mol/L;
(2)9.36g氯化钠的物质的量n=$\frac{9.36g}{58.5g/mol}$=0.16mol,50g质量分数为98%的浓硫酸中含有的硫酸的物质的量n=$\frac{50g×98%}{98g/mol}$=0.5mol.
在加热条件下,氯化钠和浓硫酸发生反应:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4,故可知浓硫酸过量,应根据氯化钠的物质的量来计算.设生成的HCl的物质的量为xmol,根据化学方程式可知:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4
2 2
0.16mol xmol
故有:$\frac{2}{0.16mol}=\frac{2}{xmol}$
故x=0.16mol.
将0.16molHCl气体溶于44.16g水后所得溶液的质量分数=$\frac{{m}_{溶质}}{{m}_{溶质}+{m}_{溶剂}}×100%$=$\frac{0.16mol×36.5g/mol}{0.16mol×36.5g/mol+44.16g}×100%$=11.68%.
答:所得溶液的质量分数为11.68%.
点评 本题考查了学生利用化学方程式来进行计算的能力,难度不大,应注意物质的量浓度的计算公式的应用.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 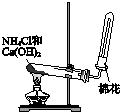 制备并收集氨气 | B. |  制备氯气 | ||
| C. | 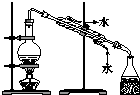 蒸馏海水得到淡水 | D. | 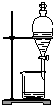 分离Na2CO3溶液与CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
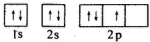
| A. | 洪特规则 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则特例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl CuCl2 NaNO3 Na2SO4 | |
| B. | BaCl2 Na2CO3 HCl (NH4)2CO3 | |
| C. | FeCl3 HCl NaCl NaOH | |
| D. | Na2CO3 Na2SO4 HCl H2SO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是

(3)据图判断,反应进行至20min时,曲线发生变化的原因 (用文字表达)
(4)10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:实验题

(1)写出下列仪器的名称:a:__________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是_____________,将仪器补充完整后进行实验,冷凝水由___________(填f或g)口通入。
(3)现需配制0.lmol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是________________。除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有:_____________。
②根据计算得知,需称量NaOH的质量为_________g。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______ ______。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
④下列操作使配制的NaOH溶液浓度偏低的有_________。
A.称量氢氧化钠时间过长 B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2>Q3 | B. | Q1+Q2<Q3 | C. | Q1+Q2>2Q3 | D. | Q1+Q2<2Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com