
| A. | SO2为原子晶体,CO2为分子晶体 | |
| B. | 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化 | |
| C. | 都是直线形结构 | |
| D. | S原子和C原子上都没有孤电子对 |
分析 A、SO2、CO2都是分子晶体;
B、SO2中S原子形成2个σ键,孤电子对个数=$\frac{1}{2}$×(6-2×2)=1,价层电子对数为3,为sp2杂化;而二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,采取sp杂化方式;
C、SO2为折线型,而二氧化碳是直线型;
D、SO2中S原子上有孤电子对.
解答 解:A、SO2、CO2都是分子晶体,故A错误;
B、SO2中S原子形成2个σ键,孤电子对个数=$\frac{1}{2}$×(6-2×2)=1,价层电子对数为3,为sp2杂化;而二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,采取sp杂化方式,所以中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化,故B正确;
C、SO2为折线型,而二氧化碳是直线型,故C错误;
D、SO2中S原子上有孤电子对,二氧化碳无孤电子对,故D错误;
故选B.
点评 本题考查了原子杂化类型的判断、晶体类型的判断,题目难度中等,原子杂化类型的判断是高考的热点,根据“杂化轨道数=σ键数+孤对电子对数”解答,比较容易.


科目:高中化学 来源: 题型:解答题
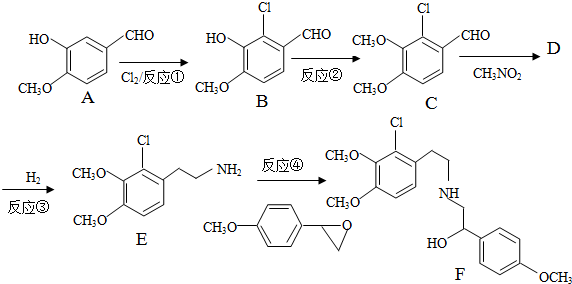
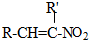 +H2O
+H2O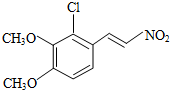 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E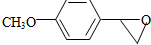 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式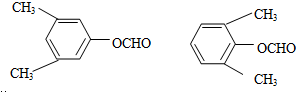 .
.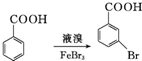 .写出以
.写出以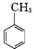 为原料制备
为原料制备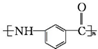 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
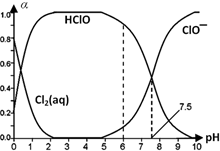 Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题. HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
H++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时用玻璃棒搅拌漏斗里的液体 | |
| B. | 加热后的蒸发皿用坩埚钳夹取 | |
| C. | 用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.2% | B. | 30.0% | C. | 75.7% | D. | 80.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g冰中最多含有氢键的数目为4NA | |
| B. | 0.1L3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| C. | 7.8gNa2O2中阴、阳离子总数为0.4NA | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3PO4═3Na++P5++4O2- | B. | H2SO4═H++SO42- | ||
| C. | NH3•H2O?NH4++O2-+H+ | D. | NH4NO3═NH4++NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com