
| 物质 | N2 | Cl2 | Br2 | I2 | O2 |
| 键能 (kJ•mol-1) | 945 | 243 | 193 | 151 | 498 |
| 键长(nm) | 0.110 | 0.199 | 0.228 | 0.266 | 0.121 |
| A. | N2>Cl2>Br2>O2>I2 | B. | O2>N2>I2>Br2>Cl2 | ||
| C. | I2>Br2>Cl2>O2>N2 | D. | N2>O2>Cl2>Br2>I2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH${\;}_{4}^{+}$+H++2OH-═NH3↑+2H2O | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g重水含有10NA个电子 | |
| B. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数约为3NA | |
| C. | 常温下0.05mol•L-1Fe2(SO4 ) 3溶液中含Fe 3+数目小于0.1NA | |
| D. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下①溶液显碱性,其主要原因为:CO32-+H2O=HCO3-+OH- | |
| B. | 可用澄清石灰水来鉴别①和②两种无色溶液 | |
| C. | 泡沫灭火器中用硫酸铝溶液和②混合快速产生CO2的反应原理为:Al3++3HCO3-=Al(OH)3↓+3CO2↑ | |
| D. | 无论①和②以何种比例、何种浓度混合,都一定有:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的Ph | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
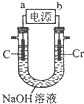
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
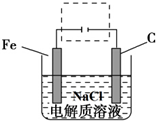 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com