
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
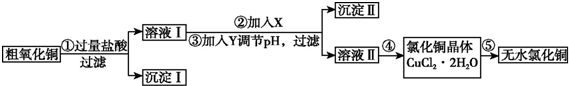
分析 粗CuO中含有FeO和不溶于酸的杂质,将粗CuO溶于过量盐酸,发生的反应有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后调节pH过滤,得到沉淀II,溶液II,除去FeCl2、CuCl2和HCl中的FeCl2,根据氢氧化物沉淀需要的pH知,应该先将FeCl2氧化为铁盐,为不引进新的杂质,氧化剂X应该为Cl2或H2O2,然后向溶液中加入CuO调节溶液的pH,所以Y可以是CuO,则沉淀II为Fe(OH)3,然后将溶液II蒸发浓缩、冷却结晶得到CuCl2.2H2O,最后在HCl氛围中加热CuCl2.2H2O得到CuCl2,
(1)氧化铜和盐酸反应生成氯化铜和水;
(2)依据过滤装置中的仪器分析回答;
(3)操作②是加入氧化剂把亚铁离子氧化为铁离子但不能引入新的杂质,氧化剂选择过氧化氢;步骤③是加入氧化铜调节溶液PH使铁离子完全沉淀;
(4)氯化氢抑制氯化铜的水解,以便达到氯化铜晶体.
解答 解:粗CuO中含有FeO和不溶于酸的杂质,将粗CuO溶于过量盐酸,发生的反应有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后调节pH过滤,得到沉淀II,溶液II,除去FeCl2、CuCl2和HCl中的FeCl2,根据氢氧化物沉淀需要的pH知,应该先将FeCl2氧化为铁盐,为不引进新的杂质,氧化剂X应该为Cl2或H2O2,然后向溶液中加入CuO调节溶液的pH,所以Y可以是CuO,则沉淀II为Fe(OH)3,然后将溶液II蒸发浓缩、冷却结晶得到CuCl2.2H2O,最后在HCl氛围中加热CuCl2.2H2O得到CuCl2,
(1)步骤①中氧化铜与盐酸反应氧化铜和盐酸反应生成氯化铜和水,反应的离子方程式是:CuO+2H+=Cu2++H2O,
故答案为:CuO+2H+=Cu2++H2O;
(2)过滤装置中的玻璃仪器有普通漏斗、玻璃棒、烧杯,
故答案为:普通漏斗、玻璃棒、烧杯;
(3)操作②是加入氧化剂把亚铁离子氧化为铁离子但不能引入新的杂质,氧化剂选择过氧化氢氧化亚铁离子的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
步骤③是加入氧化铜调节溶液PH到大于3.2,小于4.7,使铁离子完全沉淀;
故答案为:将Fe2+氧化成Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O;3.2至4.7;d;
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,是为了抑制铜离子的水解得到氯化铜晶体同时带走产生的水蒸气;
故答案为:干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
点评 本题考查混合物的分离和提纯,涉及除杂剂的选取、氧化还原反应、仪器的选取等知识点,侧重考查整体分析解答能力,会根据仪器的作用选取仪器,难点是确定调节溶液的pH时pH的取值范围,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L醋酸 | B. | 1L 0.1mol/L硫酸 | ||
| C. | 0.5L0.1mol/L盐酸 | D. | 2L0.1moL/L的磷酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑧ | B. | ③④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ①②④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 多年来我国广大农村生火做饭使用的都是化石燃料 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
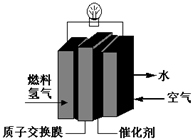
| A. | 总反应式为:O2+2H2═2H2O | |
| B. | 正极的电极反应式为:O2+4H+═2H2O+4e- | |
| C. | 通入氧气的电极发生氧化反应 | |
| D. | 通入氢气的电极为正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com