
 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,分析 (1)由图可知,平衡时A的物质的量为0.2mol,B的物质的量为0.5mol,根据c=$\frac{n}{V}$计算B的平衡浓度;
(2)A的物质的量减小、B的物质的量增大,A为反应物、B为生成物,最终A不能完全反应,属于可逆反应,根据物质的量之比等于化学计量数之比确定各物质的系数,进而书写化学方程式;
(3)根据v=$\frac{\frac{△n}{V}}{△t}$计算v(A);
(4)第4 min后A的量继续减小、B的量继续增大,反应向正反应进行;第8 min时,A、B的量不发生变化,处于平衡状态.
解答 解:(1)由图可知,平衡时A的物质的量为0.2mol,B的物质的量为0.5mol,则B的平衡浓度为$\frac{0.5mol}{2L}$=0.25mol/L,故答案为:0.2;0.25;
(2)A的物质的量减小、B的物质的量增大,A为反应物、B为生成物,最终A不能完全反应,属于可逆反应,△n(A):△n(B)=(0.8-0.2)mol:(0.5-0.2)mol=2:1,故反应方程式为:2A?B,故答案为:2A?B;
(3)反应开始至4 min时,A的平均反应速率为$\frac{\frac{0.8mol-0.4mol}{2L}}{4min}$=0.05mol•L-1•min-1,故答案为:0.05;
(4)第4 min后A的量继续减小、B的量继续增大,反应未到达平衡状态,第8 min时,A、B的量不发生变化,处于平衡状态,则v(正)=v(逆),故答案为:否;=.
点评 本题考查化学平衡计算、平衡图象等,比较基础,有利于基础知识的巩固.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 常温下,pH=1的H2SO4溶液中含有的H+的数目为0.1NA | |
| C. | 标准状况下,2.24L SO3中含有硫原子的数目为NA | |
| D. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
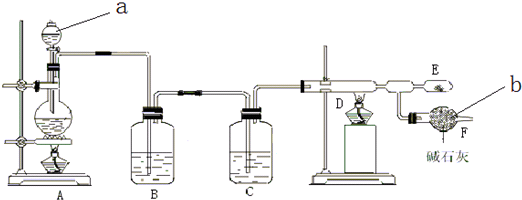
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| B | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| C | FeCl3(FeCl2)溶液 | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4)溶液 | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com