
| A. | 在能使石蕊试纸变蓝色的溶液中:Na+,AlO2-,S2-,SO42- | |
| B. | 由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,CO32-,NH4+,SO32- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4 +、Na+、Fe2+、NO3- | |
| D. | pH=2的溶液中:Na+、SO42-、NO3 -、CO32- |
分析 A.能使石蕊试纸变蓝色的溶液为碱性溶液,溶液中成长率电离氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.由水电离的H+浓度c(H+)=10-12mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢氧根离子或氢离子,铵根离子与氢氧根离子反应,碳酸根离子、亚硫酸根离子与氢离子反应;
C.加入Al能放出大量H2的溶液中存在大量氢离子或氢氧根离子,铵根离子、亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气;
D.pH=2的溶液中存在大量氢离子,碳酸根离子与氢离子反应.
解答 解:A.能使石蕊试纸变蓝色的溶液中存在大量氢氧根离子,Na+、AlO2-、S2-、SO42-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,NH4 +、Fe2+与氢氧根离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,在溶液中一定不能大量共存,故C错误;
D.pH=2的溶液为酸性溶液,溶液中存在大量氢离子,与氢离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释$\frac{c(O{H}^{-})}{c({H}^{+})}$增大的溶液:K+、Na+、SO42-、AlO2- | |
| B. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| C. | 铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3- | |
| D. | NaHCO3溶液:K+、Na+、SO42-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| B. | 根据相对分子质量的大小将共价化合物分为小分子化合物和高分子化合物 | |
| C. | 根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
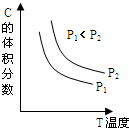 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )| A. | 正反应为吸热反应 | |
| B. | 100摄氏度时,当生成cmolC,放出E KJ热量 | |
| C. | a+b<c+d | |
| D. | 降低压强,正、逆反应速率都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=QKJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
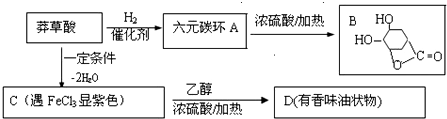
 .
.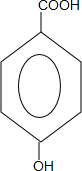 +CH3CH2OH$→_{△}^{浓硫酸}$H20+
+CH3CH2OH$→_{△}^{浓硫酸}$H20+ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1mol苹果酸和足量的钠反应生成1.5moL的H2 | |
| D. | 1mol苹果酸与Na2CO3溶液反应必需消耗2mol Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com