
| 标准状况下的气体摩尔体积 | 阿伏加德罗定律 | |
| 研究对象 | ||
| 温度压强 | ||
| 微粒的量 | ||
| 气体体积 |
| 标准状况下的气体摩尔体积 | 阿伏加德罗定律 | |
| 研究对象 | ③ | ③ |
| 温度压强 | ① | ④ |
| 微粒的量 | ⑥ | ② |
| 气体体积 | ⑦ | ⑤ |


科目:高中化学 来源: 题型:
| A、CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
| B、需要加热方能发生一定是吸热反应 |
| C、若反应X+Y═M是放热反应,该反应一定不用加热 |
D、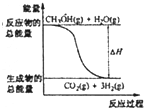 CH3OH(g)+H2O(g)═CO2(g)+3H2(g)反应能量变化如图所示,CH3OH转变H2的过程要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.1mol/L CuSO4 溶液980mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com