
| A. | 根据维生素的溶解性可以将维生素分为脂溶性和水溶性两大类 | |
| B. | 人体需要的维生素都必须从食物中摄取 | |
| C. | 维生素C具有较强的还原能力,容易被还原 | |
| D. | 维生素的作用是维持细胞的正常功能、调节人体新陈代谢 |
分析 A.维生素可根据其溶解性的不同分为脂溶性维生素和水溶性维生素两大类;
B.人体可合成维生素D;
C.维生素C具有较强的还原性;
D.维生素在人体内起到调节新陈代谢维持健康的作用.
解答 解:A.维生素分为脂溶性和水溶性两大类,故A正确;
B.人体可合成维生素D,其它维生素都必须从食物中摄取,故B错误;
C.维生素C具有较强的还原性,易被氧化,故C错误;
D.维生素在人体内起到调节新陈代谢、预防疾病、维持身体健康的作用,故D正确;
故选BC.
点评 本题考查维生素的种类及作用,题目难度不大,明确常见维生素的种类、作用为解答关键,B为易错点,注意人体可以合成维生素D,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、NO3- | |
| B. | 含有HCO3-的溶液中:K+、OH-、NO3-、Ba2+ | |
| C. | 能与金属Al反应放出H2的溶液中:Na+、NO3-、SO42-、CO32- | |
| D. | 能使酚酞试液呈红色的溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242KJ•mol-1(燃烧热) | |
| B. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114KJ•mol-1(中和热) | |
| C. | H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=-286KJ•mol-1(反应热) | |
| D. | C(石墨,S)+$\frac{1}{2}$O2(g)═CO(g)△H=-111KJ•mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 38.5mol/L | B. | 32.7mol/L | C. | 20.4mol/L | D. | 18.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
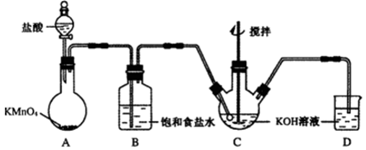
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液使蓝色石蕊试纸变红:Fe3++3H2O═3H++Fe(OH)3 | |
| B. | FeCl3溶液中滴加氨水出现红褐色沉淀:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| D. | 检验溶液中的Fe3+用KSCN溶液:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com