
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
| A.甲中气体的总压强不变 | B.各气体的物质的量浓度不变 |
| C.混合气体的平均摩尔质量不变 | D.混合气体的密度不变 |
21.(1)ABC (2)不可能 2 (3) 1, >, ② (4) 12:17
解析试题分析:(1)若固定隔板K,甲容器相当于恒温恒容的容器,当各物质的物质的量(气体的总压强不变),各气体的物质的量浓度不变,混合气体的平均摩尔质量不变时达到平衡状态。 而混合气体的密度不变始终不变;反应速率v(SO2) v(SO3),没有指明是正反应速率还是逆反应速率 ,所以ABC正确。
(2)2SO2(g)+O2(g)?2SO3(g),反应是气体体积减小的反应,隔板一定发生滑动,达到平衡后隔板K不可能处于0刻度;由于甲中充入2molSO2和1mol O2,反应向正反应方向移动,A中压强降低,最多能转化为2mol SO3,但是由于反应是可逆反应,所以SO3的物质的量在0-2 mol之间,所以达到平衡后,隔板K不再滑动,最终停留在左侧刻度0-2之间,故a小于2;
(3)由于左右两边不考虑加入的氦气,达到的平衡是相同平衡,三氧化硫体积分数相同,“隔板K最终停留在左侧1处”说明反应后气体体积为5格,左边气体减少了0.5mol,即平衡后物质的量为2.5mol,
设参加反应的二氧化硫的物质的量为2x,
故2-2x+1-x+2x=2.5,
则x=0.5mol,
则甲中二氧化硫的转化率为50%.生成三氧化硫物质的量为1mol;
但是对于乙来说,就不同了,如果无He,甲与乙是等效平衡,但乙的压强比甲小,则2SO3(g)?2SO2(g)+O2(g)的平衡向右移动了,故其转化率比大于50%;左边气体减少了0.5mol,右边增加物质的量大于0.5mol,F活塞右移,活塞F最终停留在右侧刻度大于6处;
故答案为:1,>,②;
(3)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;甲平衡后压强变为开始压强的0.8倍,即平衡后甲容器中气体2.4 mol,乙容器中气体3.4 mol,所以压强之比12:17
考点:化学平衡的计算;化学平衡建立的过程.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。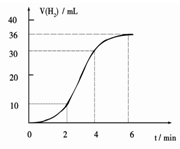
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
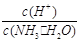 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.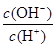
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上制取三氧化硫反应的热化学方程式为:
2SO2(g)十O2(g)  2SO3(g) △H=-198kJ·mol-1
2SO3(g) △H=-198kJ·mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号)。
A.每生成1mol SO3的同时生成0.5mol O2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是 (填序号)。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1·L。在400℃时,容积为1.0L的密闭容器中充入0.05mol SO2(g)和0.03mol O2(g),反应一段时间后,有0.04mol SO3生成。此时,该反应 (填“是”、“否”或“无法判断”)达到化学平衡状态,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为: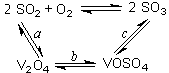
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K= 。
2SO2+O2在550 ℃时的平衡常数K= 。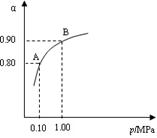
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。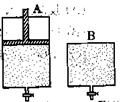
试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应aA+bB  cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
请回答下列各题:
(1)反应的化学方程式为_____________________________
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________________
(3)由计算可知,第Ⅰ段20分钟时,C的平均速率vI(C)=____________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
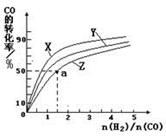
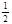 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 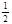 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 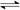 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题: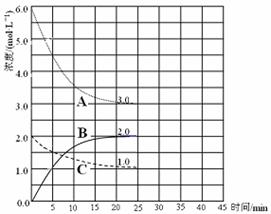
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将___ ____(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ______ ______。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ___ _____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com