
| A. | 60% | B. | 40% | C. | 30% | D. | 70% |
分析 烯烃(CnH2n)完全燃烧生成的二氧化碳气体与水蒸气的体积比是1:1,烷烃(CnH2n+2)完全燃烧生成的二氧化碳气体与水蒸气的体积比小于1:1,A、B(烯烃)混合气体完全燃烧生成的二氧化碳气体与水蒸气的体积比是4:4.8<1:2,说明A是烷烃.根据题干所给体积关系可知,A(烷烃)、B(烯烃)混合物的平均化学式是C2H4.8.分子组成最简单的烯烃是CH2═CH2(B),则A(烷烃)必定是CH3CH3.设CH2═CH2与CH3CH3的体积比是a:b,然后根据根据生成原子守恒计算.
解答 解析:烯烃(CnH2n)完全燃烧生成的二氧化碳气体与水蒸气的体积比是1:1.烷烃(CnH2n+2)完全燃烧生成的二氧化碳气体与水蒸气的体积比小于1:1.A、B(烯烃)混合气体完全燃烧生成的二氧化碳气体与水蒸气的体积比是4:4.8<1:2,则A是烷烃.
在同温、同压下,混合烃与生成的二氧化碳、气态水的体积比是2:4:4.8,则A(烷烃)、B(烯烃)混合物的平均化学式是C2H4.8.分子组成最简单的烯烃是CH2═CH2(B),则A(烷烃)必定是CH3CH3.
设CH2═CH2与CH3CH3的体积比是a:b,则:
$\frac{4a+6b}{2a+2b}$=$\frac{4.8}{2}$
解得a:b=3:2
所以乙烯在A、B混合气体中所占的体积分数是$\frac{3}{3+2}$×100%=60%,
故选:A.
点评 本题考查了根据混合气体的平均分子式来确定成分气体的化学式和体积比,题目难度不大,要用讨论的方法来确定物质的成分,注意掌握此类题目的解题方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molCH4与4molCl2在光照下完全反应可生成1molCCl4 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 乙烯能被酸性高锰酸钾溶液氧化,而苯不易 | |
| D. | 1体积的C2H4完全燃烧需同温同压下3体积的O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
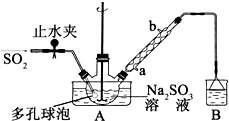 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
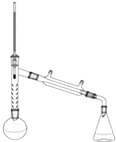 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: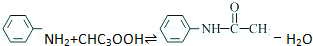
| 名称 | 性状 | 密度/(g/cm3) | 沸点/℃ | 溶解性 |
| 苯胺 | 无色油状液体,有还原性 | 1.02 | 184.4 | 微溶于水 易溶于乙醇、乙醚等 |
| 乙酸 | 无色液体 | 1.05 | 118.1 | 易溶于水 易溶于乙醇、乙醚 |
| 酰苯胺 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸铵在室温下能自发发生分解,是由于反应生成了易挥发的气体,使体系的熵增大 | |
| B. | 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 与外界隔离的体系,自发过程将导致体系的熵减小 | |
| D. | 在一定条件下,非自发进行的反应也能够发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10 | B. | 9:1 | C. | 1:9 | D. | 99:21 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com