
| A. | 加热NH4HCO3 | B. | 加热Fe(OH)3 | C. | 加热NaOH | D. | 加热CaCO3 |
科目:高中化学 来源: 题型:解答题
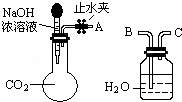 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠原子有强还原性,钠离子有弱氧化性 | |
| B. | 钠离子浓度大的溶液一定显碱性 | |
| C. | 由于钠很活泼,所以一定能从溶液中置换出金属活动性顺序表中钠后面的金属 | |
| D. | 钠是电和热的良导体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的密度之比为 1:1 | B. | 它们的分子数目之比是 1:1 | ||
| C. | 它们的体积之比是 1:1 | D. | 它们的氧原子数目之比为 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷、辛醛 | B. | 乙炔、乙烯 | C. | 乙烯、庚烯 | D. | 苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中都是铝过量 | B. | 甲中铝不足、乙中铝过量 | ||
| C. | 甲中酸过量、乙中铝过量 | D. | 甲中酸过量、乙中铝过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水也是一种电解质 | |
| B. | 无论是酸性、中性还是碱性稀溶液,只要温度恒定,c(H+)×c(OH-)是一个常数 | |
| C. | 一定温度下,0.1mol•L-1的磷酸溶液中H+主要来自于酸的第一步电离 | |
| D. | 强碱溶液中不存在H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com