
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
分析 金属的金属性越强,其单质与酸或水反应生成氢气越容易,其最高价氧化物的水化物碱性越强;较活泼的金属能置换出较不活泼金属,据此判断金属性强弱.
解答 解:金属的金属性越强,其单质与酸或水反应生成氢气越容易,其最高价氧化物的水化物碱性越强;较活泼的金属能置换出较不活泼金属,只有D能与水反应生成氢气,说明D金属性很强;将A投入C的盐溶液中可置换出金属C,说明金属性A>C;B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,说明金属性B>A,所以金属性强弱顺序是D>B>A>C,
故选B.
点评 本题考查金属的金属性强弱判断,题目难度不大,金属的金属性强弱判断方法有:金属与酸或水反应生成氢气难易程度、其最高价氧化物的水化物碱性强弱、金属之间的置换反应等,注意不能根据失电子多少判断金属性强弱,要根据失电子难易程度判断金属性强弱,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
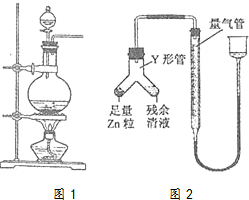 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气和液氯是两种不同物质 | |
| B. | 新制氯水溶液中存在两个平衡状态 | |
| C. | 久置的氯水,溶液的PH会变小 | |
| D. | 向氯水中滴加紫色石蕊试剂,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 | |
| C. | 在含FeC12杂质的FeCl3溶液中通入足量C12后,充分加热除去过量的C12,不能得到纯净的FeC13溶液 | |
| D. | 饱和氯水既有酸性又有漂白性,加入适量NaHCO3固体,其漂白性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com