
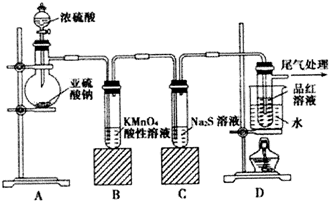
分析 (1)依据仪器形状说出其名称;
(2)二氧化硫具有还原性,能够还原酸性的高锰酸钾;
(3)硫化钠中硫离子具有强的还原性,能够被空气中氧气氧生成硫单质;
(4)根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色来解答;
(5)浓硝酸具有强的氧化性,能够氧化亚硫酸根离子生成硫酸根离子,据此解答;
(6)氧化还原反应中得电子的元素被还原;根据铜和转移电子之间的关系式计算转移电子个数.
解答 解;(1)依据仪器形状可知装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)二氧化硫具有还原性,能够还原酸性的高锰酸钾,能够使高锰酸钾褪色,故答案为:溶液颜色由紫红色逐渐退去;还原性;
(3)硫化钠中硫离子具有强的还原性,能够被空气中氧气氧生成硫单质,离子方程式:2S2-+O2+2H2O═2S+4OH-;
故答案为:2S2-+O2+2H2O═2S+4OH-;
(4))因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(5)浓硝酸可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体,所以不能把分液漏斗中的浓硫酸换作浓HNO3;
故答案为:是;浓硝酸可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体;
(6)反应8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe203+16SO2中铜元素、氧元素在得电子化合价降低,被还原;
设转移电子数为x.
8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe203+16SO2 转移电子
8mol 100NA
0.8mol x
x=10NA,
故答案为:Cu、O;10NA.
点评 本题考查二氧化硫的制取及二氧化硫的性质实验,明确反应原理、二氧化硫的性质是解答本题的关键,注意依据方程式计算氧化还原反应电子数转移数目,题目难度中等.


科目:高中化学 来源: 题型:选择题
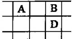 有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )| A. | E元素位于周期表中的第三周期、ⅥA族 | |
| B. | B的简单阴离子比D的简单阴离子还原性强 | |
| C. | B与C形成的化合物中一定含有共价键 | |
| D. | A、B两元素形成的常见化合物的分子中均含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=y,H2O 是还原产物 | B. | n=2m,R2+ 是还原剂 | ||
| C. | m=4,O2发生氧化反应 | D. | m=2y,R2+ 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的醇溶液,加热 | B. | 氢氧化钠的水溶液,加热 | ||
| C. | 酯、稀硫酸,加热 | D. | 银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
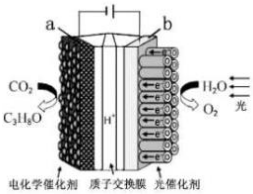
| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a 极区向b 极区迁移 | |
| C. | 每有44 g CO2被还原,则生成标准状况下 33.6 L O2 | |
| D. | a 电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用高锰酸钾酸性溶液可直接除去乙烷中的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2可使石蕊试液褪色 | B. | SO2有漂白和杀菌作用 | ||
| C. | SO2溶于水后生成H2SO4 | D. | SO2是一种大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/LKOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com