
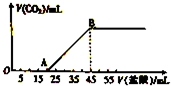
 ��5.08g��Na2CO3��NaHCO3��ɵĹ���������ȫ����ˮ���Ƴ���Һ��Ȼ�������Һ����μ���2mol?L-1�����ᣬ�������������������CO2�������״�����Ĺ�ϵ��ͼ��ʾ��
��5.08g��Na2CO3��NaHCO3��ɵĹ���������ȫ����ˮ���Ƴ���Һ��Ȼ�������Һ����μ���2mol?L-1�����ᣬ�������������������CO2�������״�����Ĺ�ϵ��ͼ��ʾ������ ��1��Na2CO3��NaHCO3��ɵĻ�����м������ᣬ�ȷ���̼���������ᷴӦ����̼���������Ȼ��ƣ�Ȼ��̼�����������ᷴӦ���ɶ�����̼���壻
��2�����ͼ���֪��������35mL����ʱ��20��35mL����̼������������ķ�Ӧ���ɶ�����̼���壻
��3������OA�εķ�Ӧ������������������̼���Ƶ����ʵ������ٸ��������������̼�����Ƶ����ʵ���������������ߵ����ʵ���֮�ȣ�
��4��̼���������ȷֽ�Ϊ̼���ơ�������̼��ˮ��
��� �⣺��1�����������̼�����������ᷴӦ����̼�����ƣ�Na2CO3+HCl�TNaHCO3+NaCl������OA�ε����ӷ�Ӧ����ʽΪ��CO32-+H+�THCO3-��
�ʴ�Ϊ��CO32-+H+�THCO3-��
��2�����ͼ���֪��������35mL����ʱ��25��35mL����̼������������ķ�Ӧ���ɶ�����̼���壬
�����ɶ�����̼�����ʵ���Ϊn����������ʱ���ĵ�������ʵ���Ϊ��35-20����10-3L��2mol•L-1=0.03mol����
HCO3-+H+�TCO2��+H2O
1 1
0.03mol n
��n=0.03mol����״���������Ϊ0.03mol��22.4L/mol=0.672L����Ϊ672mL��
�ʴ�Ϊ��672��
��3������OA�εķ�Ӧ��Na2CO3+HCl�TNaHCO3+NaCl����֪n��Na2CO3��=n��HCl��=2mol/L��0.02L=0.04mol��
�����������ɵã�n��NaHCO3����84g/mol+106g/mol��0.04mol=5.08g����ã�n��NaHCO3��=0.01mol��
��ԭ�������Na2CO3��NaHCO3�����ʵ���֮��Ϊ0.04mol��0.01mol=4��1��
�ʴ�Ϊ��4��1��
��4��NaHCO3�������ȷֽ�Ļ�ѧ����ʽΪ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
�ʴ�Ϊ��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
���� ���⿼�����ﷴӦ�ļ��㣬��Ŀ�Ѷ��еȣ���ȷ��Ӧ���Ⱥ�˳��ͼ����ÿ��ͼ���Ӧ�Ļ�ѧ��Ӧ�ǽ����Ĺؼ�������������ѧ���ķ�����������ѧ����������


 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | TiCl4�ڷ�ӦI���ǻ�ԭ����ڷ�Ӧ������������ | |
| B�� | C��Mg�ڷ�Ӧ�о�Ϊ��ԭ���������� | |
| C�� | ÿ����19.2 g Ti����Ӧ���й�ת��1.6 mol e- | |
| D�� | ��ӦI��b=c=2����ӦII��Mg�Ļ�ԭ�Դ���Ti |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��K+��HCO3- | B�� | NH4+��Al3+��SO42- | C�� | Na+��AlO2-��NO3- | D�� | Cu2+��SO42-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
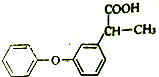 �밴Ҫ��ش��������⣺
�밴Ҫ��ش��������⣺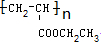 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2��Na2CO3��NaOH | B�� | SiO2��Si��Na2SiO3 | ||
| C�� | NH3��NO2��HNO3 | D�� | S��SO2��NaHSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������������Ƿֱ���ȫȼ�գ����߷ų�������һ���� | |
| B�� | ������ȼ����Ϊ285.8kJ/mol��������ȼ�յ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g���T2H2O��l����H=-285.8 kJ/mol | |
| C�� | 2H2��g��+O2��g���T2H2O��l����H=-Q1 kJ/mol 2H2��g��+O2��g���T2H2O��g����H=-Q2 kJ/mol����Q1��Q2 | |
| D�� | ��֪�к���Ϊ57.3 kJ/mol��������0.5molH2SO4��Ũ��Һ�뺬1molNaOH����Һ��ϣ��ų�����������57.3kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | M��N��Y��X��Z | B�� | Y��X��N��M��Z | C�� | N��M��Y��X��Z | D�� | X��Z��N��M��Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
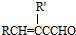 +H2O��R��R���ʾ�������⣩���߷��ӻ�����PVB�ĺϳɾ�����һ����ҪӦ�ã�
+H2O��R��R���ʾ�������⣩���߷��ӻ�����PVB�ĺϳɾ�����һ����ҪӦ�ã�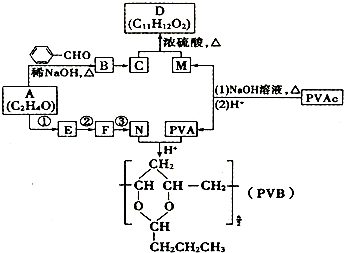

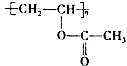
 �ϳ�B�Ļ�ѧ����ʽ��
�ϳ�B�Ļ�ѧ����ʽ��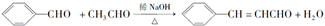 ��
��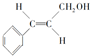 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
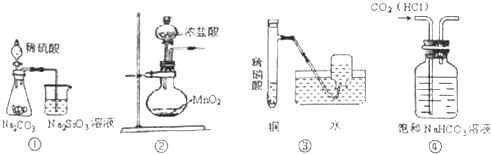
| A�� | ͼ�ٿ�֤������ǿ����H2SO4��H2CO3��H2SiO3 | |
| B�� | ͼ�ڿ�����ʵ�����Ʊ��������� | |
| C�� | ͼ�ۿ�����ʵ�����Ʊ�����NO���� | |
| D�� | ͼ�ܿɳ�ȥCO2������HCl���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com