
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
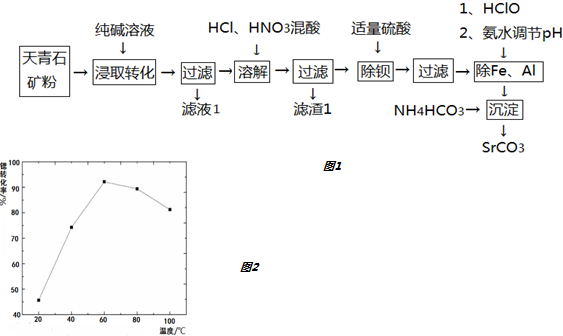
分析 相同温度时溶解度SrCO3<SrSO4,溶解度大的物质能转化为溶解度小的物质,将天青石矿粉与Na2CO3溶液搅拌混匀,发生的离子反应方程式为:SrSO4+CO32-=SrCO3+SO42-,由物质的溶解性可知,沉淀为SrCO3、BaCO3、FeO、Fe2O3、Al2O3、SiO2等,加入盐酸和硝酸,只有碳酸盐和金属氧化物与盐酸反应,则SrCO3、BaCO3、FeO、Fe2O3、Al2O3均与盐酸反应,SiO2为滤渣1,向所得滤液中加入浓硫酸,能和浓硫酸反应的为钡离子,生成硫酸钡沉淀,然后过滤;向所得滤液中先加入次氯酸,次氯酸具有强氧化性,能将亚铁离子氧化生成铁离子,充分反应后再用氨水调pH约为7,根据生成氢氧化物沉淀pH知,得到的沉淀是Fe(OH)3、Al(OH)3,然后过滤;向Ⅳ所得滤液中加入稍过量NH4HCO3,发生复分解反应生成沉淀SrCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3.
(1)相同温度时溶解度SrCO3<SrSO4,溶解度大的物质能转化为溶解度小的物质,当转化完成时,根据Ksp(SrCO3)计算c(Sr2+),再根据Ksp(SrSO4)计算c(SO42-);(2)分析过程可知该工艺滤液1含较多的Na+、SO42-,滤渣1的主要成分为SiO2;
(3)KspSrSO4较小,硫酸过量后会生成SrSO4沉淀,降低产率;
(4)Ksp(SrCO3)=1.6×10-10,碳酸锶是难溶物,锶离子与碳酸氢根离子反应生成了碳酸锶沉淀;气体的溶解度随着温度的升高而降低;
(5)SrO与铝粉充分反应生成3SrO•Al2O3、Sr根据原子守恒书写化学方程式.
解答 解:(1)相同温度时溶解度SrCO3<SrSO4,溶解度大的物质能转化为溶解度小的物质,所以将天青石矿粉和Na2CO3溶液充分混合,发生的反应为SrSO4+Na2CO3=SrCO3+Na2SO4,当转化完全时,混合液中的c(CO32-)=1.0×10-3 mol•L-1,Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.6×10-10,当转化完成时,混合液中c(CO32-)=1.0×10-3mol/L,
所以c(Sr2+)=$\frac{1.6×1{0}^{-10}}{1.0×1{0}^{-3}}$=1.6×10-7mol/L,c(SO42-)=$\frac{3.2×1{0}^{-7}}{1.6×1{0}^{-7}}$=2.0mol/L,
故答案为:SrSO4+Na2CO3=SrCO3+Na2SO4;2.0mol/L;
(2)将天青石矿粉与Na2CO3溶液搅拌混匀,发生的离子反应方程式为:SrSO4+CO32-=SrCO3+SO42-,滤液1含较多的Na+、SO42-,所以滤液1的主要成分为Na2SO4或硫酸钠,由物质的溶解性可知,沉淀为SrCO3、BaCO3、FeO、Fe2O3、Al2O3、SiO2等,加入盐酸和硝酸,只有碳酸盐和金属氧化物与盐酸反应,则SrCO3、BaCO3、FeO、Fe2O3、Al2O3均与盐酸反应,SiO2为滤渣1,
故答案为:Na2SO4或硫酸钠;SiO2;
(3)流程中第二次过滤后,向所得滤液中加入浓硫酸,能和浓硫酸反应的为钡离子,生成硫酸钡沉淀,除去钡离子,若硫酸过量后会生成SrSO4沉淀,降低产率,
故答案为:硫酸过量后会生成SrSO4沉淀,降低产率;
(4)由于Ksp(SrCO3)=1.6×10-10,碳酸锶是难溶物,锶离子与碳酸氢根离子反应生成了碳酸锶沉淀,反应的离子方程式为:Sr2++2HCO3-=SrCO3↓+CO2↑+H2O,气体的溶解度随着温度的升高而降低,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出,
故答案为:Sr2++2HCO3-=SrCO3↓+H2O+CO2↑;升温有利于CO2的逸出;
(5)根据题干信息,SrO与铝粉充分反应生成3SrO•Al2O3、Sr,反应方程式为:6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3,
故答案为:6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.
点评 本题考查SrCO3制备实验,制备实验为高频考题,涉及沉淀溶解平衡计算、物质的分离和提纯等知识点,明确各个步骤发生的反应及溶液中存在的微粒成分是解本题关键,难点是判断各个步骤滤液中成分,题目难度中等.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3>△H4 | B. | △H1>△H2;△H3<△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3<△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛既具有氧化性也具有还原性 | |
| B. | 煤的气化和干馏原理相同 | |
| C. | 动物油加入稀硫酸生产肥皂 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、Cl-、NO3-能大量共存于pH=0的溶液中 | |
| B. | 1 L浓度为l mol•L-1的NH4Cl溶液中含有NA个NH4+ | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA | |
| B. | 25℃时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵明矾中加入过量的氢氧化钡溶液的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol | |
| C. | 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ | |
| D. | 将过量SO2通入少量氨水中的离子方程式为:SO2+2NH3•H2O═2NH4++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.
钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 葡萄糖可用于补钙药物的合成 | |
| C. | 天然药物无任何毒副作用,可长期服用 | |
| D. | 超导陶瓷、高温结构陶瓷和光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 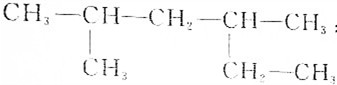 :2,4-二甲基已烷 :2,4-二甲基已烷 | |
| B. | 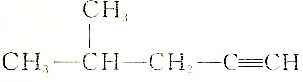 :2-甲基-4-戊炔 :2-甲基-4-戊炔 | |
| C. | 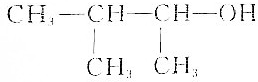 :3-甲基-2-丁醇 :3-甲基-2-丁醇 | |
| D. | CH2-CHBr-CHBr-CH3:2,3-二溴丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com