
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8 电子稳定结构。下列有关说法正确的是
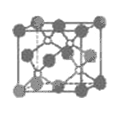
A. 磷化硼晶体的化学式为BP,属于离子晶体
B. 磷化硼晶体中每个原子均形成4个共价键
C. 磷化硼晶体的熔点高,且熔融状态下能导电
D. 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
【答案】B
【解析】A.利用均摊法计算化学式,根据磷化硼是一种超硬耐磨涂层材料,判断晶体类型;
B. 根据晶胞得出配位数为4判断;
C.根据磷化硼是原子晶体判断其熔点高,且熔融状态下不能导电;
D.根据磷化硼晶胞结构结合NaCl晶胞结构中阴阳离子的配位数均为6判断。
详解:A.晶胞中:P位于顶点和面心,数目为8![]() +6
+6![]() =4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,因为磷化硼是一种超硬耐磨涂层材料,属于原子晶体,故A错误;
=4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,因为磷化硼是一种超硬耐磨涂层材料,属于原子晶体,故A错误;
B. 该晶胞配位数为4,即每个原子均形成4条共价键,所以B选项是正确的;
C.磷化硼晶体是原子晶体,熔点高,但熔融状态下没有自由的离子所以不能导电,故C错误;
D.该晶胞配位数为4,而NaCl晶胞结构中阴阳离子的配位数均为6,所以磷化硼晶体结构微粒的空间堆积方式与氯化钠不相同,故D错误;
所以B选项是正确的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:

(1)CH4与Cl2发生反应的条件是漫射光照射;若用日光直射,可能会引起______________。
(2)实验中可观察到的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,_____,_____等。
(3)实验中生成的油状液滴的化学式为____________________。
(4)请写出其中生成一氯甲烷的化学方程式____________________。
(5)用饱和食盐水而不用水的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
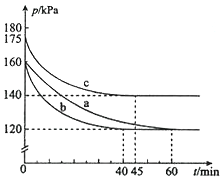
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
![]() 杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
![]() 同一周期从左到右,元素的第一电离能、电负性都是越来越大
同一周期从左到右,元素的第一电离能、电负性都是越来越大
![]() 分子中键能越大,表示分子拥有的能量越高
分子中键能越大,表示分子拥有的能量越高
![]() 所有的配合物都存在配位键
所有的配合物都存在配位键
![]() 所有含极性键的分子都是极性分子
所有含极性键的分子都是极性分子
![]() 熔融状态下能导电的化合物一定是离子化合物
熔融状态下能导电的化合物一定是离子化合物
![]() 所有的原子晶体都不导电
所有的原子晶体都不导电
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备髙效净水剂K2FeO4。

<査阅资料>O2与KOH溶液在20℃以下反应生成KC1O,在较高温度下则生成KC1O3;K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是___________;装置A中反应的离子方程式为___________________。
装置C中三颈烧瓶置于冰水浴中的目的是_______________。
(2)装置B吸收的气体是___________,装置D的作用是____________________。
(3)C中得到足量KC1O后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为________________。再加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KC1等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中。
②过滤。
③____________________。
④搅拌、静置、过滤,用乙醇洗涤2~3次,
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性NaCr(OH)溶液,反应后再加稀H2SO4调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
Cr(OH)4-+FeO42- =Fe(OH)3↓+CrO42-+OH-
2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应
B. 全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2聚合制得
)和CO2聚合制得
C. 淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1的HCl溶液逐滴滴入10.00 mL0.1 mol·L-1的NH3·H2O溶液中,其AG值变化的曲线如图所示。已知AG=![]() ,下列分析错误的是
,下列分析错误的是
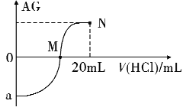
A. 滴定前HC1溶液的AG =12;图中a<0
B. M点为完全反应点,V( HCl) =10 mL,且c(Cl-) >c(NH4+)
C. 从M点到N点水的电离程度先增大后减小
D. N点溶液中:c(Cl-) =2c(NH3·H2O) +2c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下不能实现的是
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
B. Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() AlCl3
AlCl3
C. Na![]() Na2O
Na2O![]() Na2O2
Na2O2
D. 饱和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com