
【题目】已知氧化性Fe3+>Cu2+>Fe2+ . 现有一包铁粉和铜粉混合粉末,某实验小组为了确定其组成,利用1.2molL﹣1的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
组别 | ① | ② | ③ | ④ |
V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
混合粉末质量/g | 1.2 | 2.4 | 3.6 | 4.8 |
反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12[ |
分析表中数据,下列结论不正确的是( )
A.第①组反应后溶液中剩余c(Fe3+)=0.4 molL﹣1
B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0 molL﹣1
D.原混合粉末中n(Fe):n(Cu)=1:1
【答案】C
【解析】解:还原性:Fe>Cu,故Fe3+优先Fe反应(Fe+2Fe3+=3Fe2+),Fe完全反应后若Fe3+有剩余,则再与铜反应(Cu+2Fe3+=Fe2++Cu2+),所以剩余的固体可以是铜,可以是铁和铜的混合物;
根据第②组数据中可以得出FeCl3溶液全部参与反应,50mL FeCl3溶液能溶解金属质量为:2.4g﹣0.64g=1.76g>1.2g,大于第①组溶解的金属质量,故第①组金属完全反应,且FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,FeCl3物质的量为:0.05L×1.2mol/L=0.06mol,假设只发生反应Fe+2Fe3+=3Fe2+ , 参加反应金属的物质的量为0.03mol,溶解的Fe的质量为:0.03mol×56g/mol=1.68gg<1.76g,所以铁完全溶解的同时还有部分Cu溶解,则剩余的0.64g固体全部为Cu;
第③组实验中溶解金属为:3.6g﹣1.92g=1.68g,混合物中Fe恰好完全反应、Cu不反应,剩余1.92g为Cu,合金中Fe与Cu的质量之比为:1.68g:1.92g=7:8;
故第④组实验中,剩余固体为Fe、Cu,
A.根据分析可知,第①组反应中金属完全反应,1.2g合金中含有铁的物质的量为: ![]() =0.01mol,含有铜的物质的量为:
=0.01mol,含有铜的物质的量为: ![]() =0.01mol,根据反应Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Fe2++Cu2+可知,金属消耗铁离子的物质的量为:0.01mol×2+0.01mol×2=0.04mol,①反应后的溶液中铁离子浓度为:
=0.01mol,根据反应Fe+2Fe3+=3Fe2+、Cu+2Fe3+=Fe2++Cu2+可知,金属消耗铁离子的物质的量为:0.01mol×2+0.01mol×2=0.04mol,①反应后的溶液中铁离子浓度为: ![]() =0.4mol/L,故A正确;
=0.4mol/L,故A正确;
B.根据分析可知,第②、③组剩余的全部为铜,故B正确;
C.由上述分析可知,第④组实验剩余金属为Fe和Cu,参加反应金属为1.68g,其物质的量为0.03mol,由Fe+2Fe3+=3Fe2+ , 可知溶液中n(Fe2+)=0.09mol,故c(Fe2+)= ![]() =1.8mol/L,故C错误;
=1.8mol/L,故C错误;
D.第③组实验中溶解金属为:3.6g﹣1.92g=1.68g,混合物中Fe恰好完全反应、Cu不反应,剩余1.92g为Cu,合金中Fe与Cu的质量之比为:1.68g:1.92g=7:8,则二者的物质的量之比为: ![]() :
: ![]() =1:1,故D错误;
=1:1,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定不能大量共存的是
①能使红色石蕊试纸变蓝的溶液中:Na+ 、K+、CO![]() 、NO
、NO![]() 、[Al(OH)4]-
、[Al(OH)4]-
②c(H+)=0.1 mol·L-1的溶液中:Cu2+、Al3+、SO![]() 、NO
、NO![]()
③能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH![]() 、S2-、Br-
、S2-、Br-
④由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO![]()
⑤加入铝粉能产生氢气的溶液中:NH![]() 、Fe2+、SO
、Fe2+、SO![]() 、NO
、NO![]()
⑥含有大量Fe3+的溶液中:NH![]() 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
A. ①②③ B. ①③⑥
C. ③④⑤⑥ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.Al具有导电性,可用于防锈涂料制造
B.NH3具有碱性,可用于生产NH4HCO3
C.Na2O2呈淡黄色,可用于呼吸面具供氧
D.FeCl3易水解,可用于蚀刻铜制线路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是

A. 碳[C(s)]的燃烧热△H为-110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O放出73kJ的热量
C. 反应2Cu2O(s)+O2(g)=4CuO(s)的△H为292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H=35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
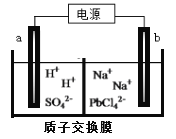
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com