
对于溶液中某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5︰6,则甲、乙两烧杯中的反应情况可能分别是( )
A. 甲、乙中都是铝过量 B. 甲中铝过量、乙中碱过量
C. 甲中酸过量、乙中铝过量 D. 甲中酸过量、乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
 ①烧杯间填满碎泡沫塑料的作用是 。
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值:
(填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的
热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g)  2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 | H—H | N—H | N≡N |
| 键能kJ·mol-1 | 436 | 391 | 945 |
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO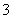 (aq)+2Cl-(aq)的ΔH= kJ·mol-1。
(aq)+2Cl-(aq)的ΔH= kJ·mol-1。
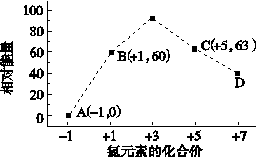
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是
A.0.5molNaCl溶解在1 L水中,所得溶液的物质的量浓度为0.5 mol/L
B.10mL 1 mol/L的硫酸溶液与100mL 0.1mol/L的硫酸溶液的物质的量浓度相同
C.1mol任何气体所含的气体分子数目都相等
D.1molCH4的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA表示阿伏加德罗常数)( )
A.在常温常压下,11.2 升氯气含有的分子数为0.5NA
B.在常温常压下,1摩尔气体含有的原子数为NA
C.32 g氧气所含原子数目为2NA
D.在同温同压下,相同体积的任何气体单质所含原子数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要制取Cl22.24L (标况下)。(1)写出相应的化学方程式。(2)求出所需的MnO2质量和被氧化HCl在标况下的体积.(不考虑HCl的消耗)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是
A. 布朗运动是胶体粒子特有的运动方式,可以据此把胶体和溶液、悬浊液区分开来。
B. 光线透过胶体时,胶体发生丁达尔现象。
C. 用渗析的方法净化胶体时,使用的半透膜只能让较小的分子.离子通过。
D. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A. 氢氧化钠的摩尔质量是40g
B. 1mol NaOH的质量是40g/mol
C. 1g H2和1g N2所含分子数相等
D. 等质量的N2、CH4、CO、H2O中CH4所含分子数最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com