
| A. | 它们都具有放射性 | |
| B. | 尽管它们结构不同,但它们的化学性质相同 | |
| C. | 它们互为同分异构体 | |
| D. | 它们的原子最外层均为8电子 |
分析 A.放射性元素镭、钍、锕在放射性衰变中都能形成质子数为86的三种不同原子,分别被称为“镭射气”、“钍射气”、“锕射气”;
B.${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,质子数相同,最外层电子数相同,化学性质由最外层电子数决定;
C.分子式相同,结构不同的有机物互为同分异构体;
D.原子序数86,有6个电子层,最外层8个电子.
解答 解:A.放射性元素镭、钍、锕在放射性衰变中都能形成质子数为86的三种不同原子,分别被称为“镭射气”、“钍射气”、“锕射气”,${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,为放射性元素,故A正确;
B..${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,质子数相同,最外层电子数相同,化学性质由最外层电子数决定,尽管它们结构不同,但它们的化学性质相同,故B正确;
C.${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,是质子数相同中子数不同的同种元素的不同原子为同位素,不是同分异构体,故C错误;
D.原子序数86,有6个电子层,最外层8个电子,故D正确;
故选C.
点评 本题考查了原子结构、微粒关系、同位素、同分异构体等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,但NaClO强电解质 | |
| B. | HC1、SO2、HBr三种气体都可用浓硫酸干燥 | |
| C. | 向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| D. | SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
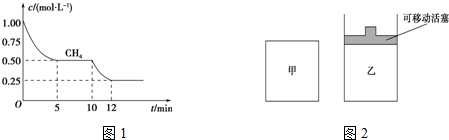
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
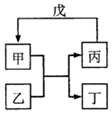 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
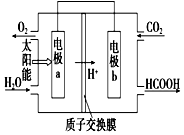 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com