
分析 强弱电解质的根本区别是在水溶液中能否完全电离,弱电解质不能完全电离,存在电离平衡,电离平衡是动态平衡,条件改变时平衡发生移动,KHSO4是强电解质,KHSO3也是强电解质,亚硫酸是弱电解质,分部电离,KHSO4能够与KHSO3反应生成二氧化硫气体,据此分析.
解答 解:弱电解质不能完全电离,存在电离平衡,电离平衡是动态平衡,条件改变时平衡发生移动,KHSO4是强电解质,在水溶液中的电离方程式为KHSO4=K++H++SO42-,KHSO3也是强电解质,亚硫酸是弱电解质,分部电离,KHSO3在水溶液中的电离方程式为KHSO4=K++HSO3-,HSO3-?H++SO32-,KHSO4能够与KHSO3反应生成二氧化硫气体,反应的离子方程式为H++HSO3-=H2O+SO2↑,
故答案为:电离;动态;移动;强;KHSO4=K++H++SO42-;强;KHSO4=K++HSO3-,HSO3-?H++SO32-;有气体生成;H++HSO3-=H2O+SO2↑.
点评 本题考查了强弱电解质的基本知识,注意弱电解质在水溶液中存在电离平衡和离子方程式的书写,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-5mol/L | B. | 1×10-6mol/L | C. | 1×10-8mol/L | D. | 1×10-9molL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 今年我国雾霾天气比较严重,雾霾属于气溶胶 | |
| B. | 煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 可以利用盐析和变性来分离、提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

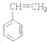 )为原料工业制备苯乙炔(
)为原料工业制备苯乙炔( )的流程如下:
)的流程如下: $→_{(1)}^{Br_{2}}$甲$\overrightarrow{(2)}$
$→_{(1)}^{Br_{2}}$甲$\overrightarrow{(2)}$

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O
+2NaBr+2H2O ,其苯环上二氯取代物有三种的芳香烃的名称为对二甲苯或1,4-二甲苯.
,其苯环上二氯取代物有三种的芳香烃的名称为对二甲苯或1,4-二甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com