
| A. | C60气化和金刚石熔化克服的作用力相同 | |
| B. | 甲酸甲酯的熔点低于乙酸的熔点 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 分子晶体的熔沸点低,常温下均呈液态或气态 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.70 g食盐 | |
| B. | 用量筒量取12.36 mL盐酸 | |
| C. | 用酸式滴定管量取21.20 mL 0.10 mol•L-1的H2SO4溶液 | |
| D. | 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
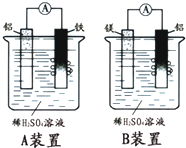 有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,
有甲、乙两位学生分别利用如图A、B装置的原电池反应检测金属的活动性顺序,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
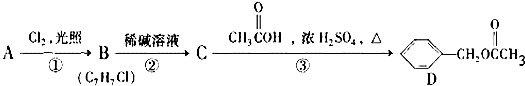
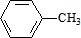 ,C的名称:苯甲醇.
,C的名称:苯甲醇.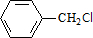 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$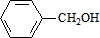 +NaCl.
+NaCl. .
.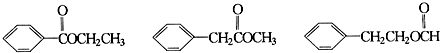 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SO3都是极性分子 | |
| B. | 元素电负性越大的原子,吸引电子能力越强 | |
| C. | 非极性键可以存在于化合物中 | |
| D. | 离子化合物的熔点不一定比共价化合物的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
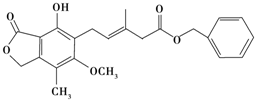
| A. | 该化合物可与NaHCO3溶液反应放出CO2气体 | |
| B. | 1 mol该化合物最多可以与3 mol NaOH反应 | |
| C. | 该化合物可以使酸性KMnO4溶液褪色 | |
| D. | 该化合物可以在光照下与Cl2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+一定存在 | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | Ba2+一定不存在,Mg2+可能存在 | D. | Cl-一定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com