
某研究小组探究SO2和Fe(NO3)3溶液的反应。

已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1
请回答:
(1) 装置A中反应的化学方程式是__________________________________
_________________________________________________________________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是__________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
猜想1: __________________________________________________;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO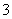 反应;
反应;
①按猜想2,装置B中反应的离子方程式是__________________________,证明该猜想正确应进一步确认生成了________。
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A
和1.0 mol B,反应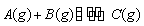 经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A、反应在前5 s的平均速率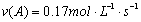
B、保持其他条件不变,升高温度,平衡时 ,则反应的
,则反应的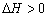
C、相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气和氯乙烯都是重要的化工产品,年产量均在1 07t左右。
07t左右。 氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空 气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
(4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C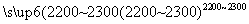 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl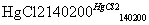 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、___________ __________。
__________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学物质在实际生产生活和科技等方面的应用不正确的是( )。
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl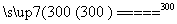 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_____________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点-33 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下图(热源及夹持装置略去)

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________________________。
装置D中发生反应的化学方程式为_____________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.苯不能使酸性KMnO4溶液退色,与甲烷性质相似,因此苯为饱和烃
B.苯的结构简式为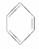 ,有三个双键,可与溴水发生加成
,有三个双键,可与溴水发生加成
C.苯的邻位二元取代产物只有一种
D.苯的邻位二元取代产物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,某同学做乙醇氧化实验时将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰的a、b两点时现象明显不同,请写出a、b两点的实验现象,并解释产生该现象的原因。

| 实验现象 | 原因 | |
| a | ||
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知碳碳单键可以绕键轴自由旋转,对结构简式为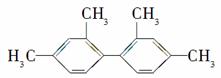 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.分子中至少有16个碳原子处于同一平面上
D.该烃属于苯的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com