
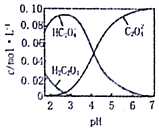
 已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | PH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| C. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| D. | PH=7的溶液中:c(Na+)>2 c(C2O42-) |
分析 A.依据图象可知pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)<c(HC2O4-);
B.依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol/L的溶液中c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-);
C.c(HC2O4-)=c(C2O42-)的溶液中c(Na+)<0.100 mol•L-1+c(HC2O4-);
D.pH=7的溶液中,(H+)=c(OH-),根据电荷守恒判断.
解答 解:A.由图象可知,pH=2.5的溶液中c(H2C2O4)和c(C2O42-)浓度之和小于c(HC2O4-),则c(H2C2O4)+c(C2O42-)<c(HC2O4-),故A错误;
B.c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1,c(HC2O4-)=c(C2O42-),电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),pH约4,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)<0.100 mol•L-1+c(HC2O4-),故B错误;
C.依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol/L的溶液中为NaHC2O4溶液,溶液中存在电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),物料守恒c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),代入计算得到c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-),故C正确;
D.pH=7,(H+)=c(OH-),根据电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(OH-),因草酸根会水解,所以c(Na+)=2c(C2O42-),故D错误;
故选C.
点评 本题考查了弱电解质的电离、离子浓度大小比较,侧重于学生的分析能力的考查,注意把握物料守恒、电荷守恒的运用,答题时注意体会,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 据2016年11月2日科技日报报道,天宫二号伴随卫星通过7次轨道控制,从天宫二号正上方飞越,并拍摄了多幅照片.拍摄照片的相机包括镜头和CCD(图象传感器)两部 分,其中镜头的材料为玻璃,CCD为半导体材料.下列叙述正确的是( )
据2016年11月2日科技日报报道,天宫二号伴随卫星通过7次轨道控制,从天宫二号正上方飞越,并拍摄了多幅照片.拍摄照片的相机包括镜头和CCD(图象传感器)两部 分,其中镜头的材料为玻璃,CCD为半导体材料.下列叙述正确的是( )| A. | 玻璃和半导体材料均可由SiO2制备 | |
| B. | 普通玻璃的制备原料是纯碱、黏土和石英 | |
| C. | 通讯传输的光导纤维是单晶硅 | |
| D. | 高温下利用氧化剂可使SiO2转化为Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②外 | B. | 除③外 | C. | 除②③⑤⑥外 | D. | 除③⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2比Fe3+强 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 7.8g Na2S固体和7.8g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数目为0.5NA | |
| D. | 0.5mol/LHCl 溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Q>P | |
| B. | 简单氢化物的热稳定性:Y>P | |
| C. | 简单离子的半径:Z>Y>X | |
| D. | X、Y、Z、P形成的化合物的水溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y的最高价氧化物都是气体 | |
| B. | Y、Z形成的化合物一定为共价化合物 | |
| C. | 四种元素中W元素的非金属性最强 | |
| D. | W、X、Y、Z的原子半径大小顺序一定是:Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 实验室的废酸废碱可用中和法来处理 | |
| C. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 | |
| D. | 金属钠着火时,可立即用沾水的毛巾覆盖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com