
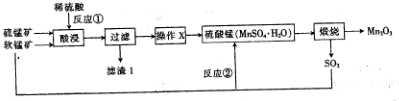
分析 软锰矿和硫锰矿加入稀硫酸充分浸泡,发生MnO2+MnS+4H+=2Mn2++S↓+2H2O,得到滤渣1含有S,滤液含有锰离子,将滤液蒸发浓缩、冷却结晶、过滤、洗涤烘干得到硫酸锰晶体,煅烧可得到Mn2O3,以此解答该题.
解答 解:软锰矿和硫锰矿加入稀硫酸充分浸泡,发生MnO2+MnS+4H+=2Mn2++S↓+2H2O,得到滤渣1含有S,滤液含有锰离子,将滤液蒸发浓缩、冷却结晶、过滤、洗涤烘干得到硫酸锰晶体,煅烧可得到Mn2O3,
(1)反应①中是利用稀硫酸溶解MnO2和MnS的混合物得到MnSO4,反应中+4价Mn发生还原反应,同时S2-发生氧化反应生成S,发生反应的离子方程式为MnO2+MnS+4H+=2Mn2++S↓+2H2O,故所得非金属单质为S,反应中的还原剂是MnS,故答案为:S;MnS;
(2)操作X的目的是从MnSO4溶液里获得MnSO4•H2O晶体,具体操作是蒸发浓缩、冷却结晶、过滤、洗涤烘干.因MnSO4•H2O在酒精中溶解度小,在洗涤操作中,常用酒精洗涤MnSO4•H2O晶体,可减小MnSO4•H2O的损失,故答案为:冷却结晶;MnSO4•H2O在酒精中溶解度小,可减小MnSO4•H2O的损失;
(3)加热时Mn2O3与浓盐酸反应放出Cl2的同时生成MnCl2和H2O,该反应的离子方程式为Mn2O3+6H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++Cl2↑+3H2O,
故答案为:Mn2O3+6H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Mn2++Cl2↑+3H2O.
点评 本题考查物质制备实验方案设计,为高频考点,侧重考查学生获取信息利用信息解答问题能力及对基本知识的灵活运用,涉及方程式和离子方程式的书写、氧化还原反应、物质分离和提纯等知识点,明确反应原理、物质性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硝基、羟基、氯原子、苯环、甲基都是官能团 | |
| B. | 邻二甲苯不存在同分异构体,说明苯分子中所有的碳碳键都是完全相同的 | |
| C. | 乙烯、苯分子中所有原子共平面 | |
| D. | CH2Cl2有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2→CH2BrCH2Br | B. | 2CH3CH3+Cl2$\stackrel{光照}{→}$2CH3CH2Cl+H2 | ||
| C. | CH3CH2OH+Na→CH3CH2ONa+H2↑ | D. | 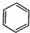 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$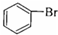 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g臭氧中含有的氧原子数为0.1NA | |
| B. | 18gD2O中含有的质子数为10NA | |
| C. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2L己烷含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 第一电力能 | 熔点 | 酸性 |
| O2->Na+ | Si<S | NaCl<NaF | HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2 min内的反应速率用B表示为0.3 mol/(L•min) | |
| B. | 在2 min内用A表示反应速率是0.4 mol/(L•min) | |
| C. | 在2 min内用C表示反应速率是0.2 mol/(L•min) | |
| D. | 当V正(B)=3V逆(D)时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
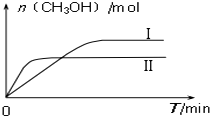 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com