
下图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并加入20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,由于浓H2SO4流入B中,则D中导管口有气泡产生.过几分钟后,无水硫酸铜粉末由无色变为蓝色.此时水浴加热后,发生化学反应,生成的气体从F处逸出,点燃气体,有绿色火焰.试回答:
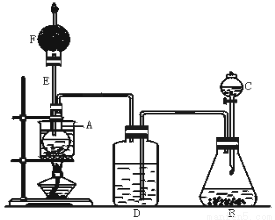
(1)B中逸出的气体主要________________.
(2)D瓶的作用是_______________.
(3)E管的作用是___________________,
(4)F管口点燃的气体是________________.
(5)A瓶中无水硫酸铜粉末变蓝的原因是____________.
(6)由A中发生的反应事实,可推断出的结论_________________.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年内蒙古鄂尔多斯市高三模拟化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质](15分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;B的最外层电子数为其内层电子数的3倍;A与C可形成离子化合物C3A2;D是地壳中含量最多的金属元素;E原子核外的M层中有两对成对电子;F原子核外最外层只有1个电子,其余各层电子均充满。根据以上信息,回答下列问题:(A、B、C、D、E、F用所对应的元素符号表示)。
(1)F原子的核外电子排布式为 ,A、B、C、D、E的第一电离能最小的是 。
(2)C的氧化物的熔点远高于E的氧化物的熔点,原因是 。
(3)比较B、E的氢化物的沸点_________。
(4)A的最高价含氧酸根离子中,其中心原子是 杂化,E的低价氧化物的空间构型为 。
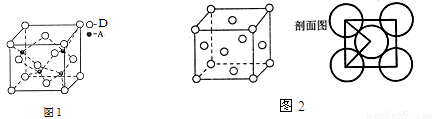
(5)A、D形成某种化合物的晶胞结构如图1,则其化学式为 。
(6)F单质的晶体的晶胞结构如图2。若F原子的半径是r cm,则F单质的密度的计算公式是 。(用NA表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省达州市高二3月月考化学试卷(解析版) 题型:选择题
将浓度为0.2mol/LNH4Cl溶液加水不断稀释,下列各量增大的是
A.c(H+) B.Kh(NH4Cl)(水解常数)
C.c(OH— D.c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二4月月考化学试卷(解析版) 题型:选择题
为了鉴定卤代烃中所含有的卤素原子,现有下列实验操作步骤。正确的顺序是
①加入AgNO3
②加入少许卤代烃试样
③加热
④加入5ml 4mol/LNaOH溶液
⑤加入5ml 4mol/LHNO3溶液
A.②④③① B.②④③⑤① C.②⑤③①④ D.②⑤①③④
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二4月月考化学试卷(解析版) 题型:选择题
下列各组物质不属于同分异构体的是
A.2,2-二甲基丙醇和2-甲基丁醇
B.邻氯甲苯和对氯甲苯
C.2-甲基丁烷和戊烷
D.乙醇和乙醚
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省宜春市高二下学期第一次月考化学试卷(解析版) 题型:选择题
A、B是相对分子量不相等的两种有机物,无论A、B以何种比例混合,只要混合物的总质量不变,完全燃烧后生成CO2的质量也不变。符合这一条件的组合是
A.HCHO CH3COOH
B.HCOOCH3 CH3COOH
C.C2H4 C2H5OH
D.CH3OH C10H8O2
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省宜春市高二下学期第一次月考化学试卷(解析版) 题型:选择题
我们能在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”(见甲)的有机化合物,而与视黄醛相似结构的维生素A(见乙)常作为保健药物。则下列有关叙述正确的是
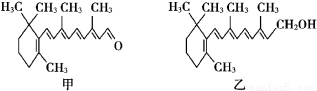
A.视黄醛的分子式为C20H28O
B.维生素A分子结构中含有苯环、碳碳双键和羟基
C.维生素A是视黄醛的氧化产物
D.1 mol视黄醛在一定条件下最多能与8 mol H2发生反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市东城区高三综合能力测试二理综化学试卷(解析版) 题型:填空题
(14分)减少二氧化碳的排放是一项重要课题。
(1)CO2经催化加氢可合成低碳烯烃: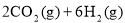

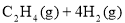
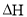
在0.1 MPa时,按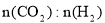 =1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
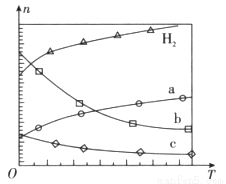
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如下图所示。
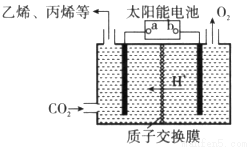
①该工艺中能量转化方式主要有__________。
②b为电源的__________(填“正”或“负”)极,电解时,生成乙烯的电极反应式是__________。
(3)以CO2为原料制取碳(C)的太阳能工艺如图所示。
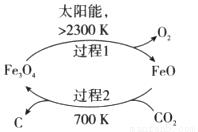
①过程1每反应1mol Fe3O4转移电子的物质的量为__________。
②过程2发生反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省达州市高一3月月考化学试卷(解析版) 题型:填空题
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,A是地壳中含量最高的元素,B、C、D同周期,E和其他元素既不在同一周期也不在同一主族,D的氢化物及其最高价氧化物对应的水化物均为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (选“A”或“D”)。
(2)元素C在元素周期表中的位置是 ,B的最高价氧化物对应的水化物的电子式为 。
(3)A、D、E可以形成多种盐,其中一种盐中A、D、E三种元素的原子个数比为2:2:1,该盐的名称为 。它的水溶液与D的氢化物的水溶液反应可生成D的单质,该反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com