
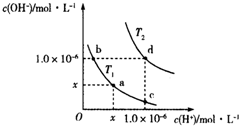
| A. | T2>25℃ | B. | x=1.0×10-7 | ||
| C. | KW(a)=KW(d) | D. | b点溶液呈碱性,c点溶液呈酸性 |
分析 A.升高温度促进水的电离;
B.常温下,纯水中c(H+)=1.0×10-7mol/L;
C.升高温度,促进水的电离,水的离子积增大;
D.b点溶液中c(H+)>c(OH-),c点溶液中c(H+)<c(OH-).
解答 解:A.升高温度促进水的电离,T2时纯水中c(H+)=1.0×10-6mol/L,比25℃时纯水中c(H+)大,所以T2>25℃,故A正确;
B.常温下,纯水中c(H+)=1.0×10-7mol/L,所以x=1.0×10-7,故B正确;
C.升高温度,促进水的电离,水的离子积会增大,T2>25℃,所以KW(a)<KW(d),故C错误;
D.b点溶液中c(H+)>c(OH-),则溶液显酸性,c点溶液中c(H+)<c(OH-),则溶液显碱性,故D正确.
故选C.
点评 本题考了水的离子积常数计算、溶液的酸碱性的判断等,题目难度不大,注意温度对水的电离的影响以及溶液酸碱性的判断方法.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | CH2═CH-CH═CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH2-CH3 | |
| C. |  | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | SO2 | H2S |
| B | CO2 | Cl2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾是常用的水处理剂,可以用来淡化海水 | |
| B. | 患有胃溃疡的病人的胃酸过多,可以用小苏打医治 | |
| C. | 生活中常用的铝制品与不锈钢制品不易腐蚀,其原理不同 | |
| D. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
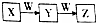 X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )| A. | Al | B. | Si | C. | O2 | D. | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com