
解析:与Zn反应的硫酸的浓度未确定,因此需讨论,若为稀H2SO4,则
若气体全为H2,则有:
Zn + H2SO4(稀)![]() ZnSO4+H2↑
ZnSO4+H2↑
1 1 1
0.1 mol 0.1 mol ![]() =0.1 mol
=0.1 mol
若气体全为SO2,则有:
Zn + 2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
1 2 1
0.1 mol 0.2 mol ![]() =0.1 mol
=0.1 mol
若气体为SO2、H2的混合气体,
![]()
设SO2的质量为m g,n(SO2)=![]() mol,n(H2)=(0.1-
mol,n(H2)=(0.1-![]() )mol。
)mol。
Zn + 2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O
ZnSO4+SO2↑+2H2O
1 2 1
![]() mol
mol ![]() mol
mol ![]() mol
mol
Zn + H2SO4(稀)![]() ZnSO4+H2↑
ZnSO4+H2↑
1 1 1
(0.1-![]() ) mol (0.1-
) mol (0.1-![]() ) mol (0.1-
) mol (0.1-![]() ) mol
) mol
答案:若气体全为H2,耗Zn 0.1 mol,耗H2SO4 0.1 mol
若气体全为SO2,耗Zn 0.1 mol,耗H2SO4 0.2 mol
若气体为SO2和H2,耗Zn 0.1 mol,耗H2SO4(0.1+![]() ) mol
) mol


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
A、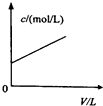 如图中曲线可表示向0.1mol/L CH3COONa溶液中加水稀释的过程中OH-浓度随溶液体积的变化趋势 | B、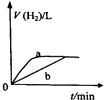 如图中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)跟同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | C、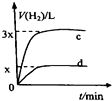 如图中曲线c、d分别表示等质量的铝分别跟过量烧碱溶液、过量盐酸反应过程中产生H2体积的变化趋势 | D、 如图中曲线可表示足量锌与一定量稀醋酸反应过程中,Zn2+浓度的变化趋势(假设反应过程中溶液体积保持不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:
1. 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。
你认为上述方案可行的是________________________________。
2. 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____ ____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________ ③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________ ④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________
3.某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com