
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
分析 (1)根据盖斯定律,观察目标方程式可知,①×2+②+③,即得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g),故△H=2△H1+△H2+△H3=-246.4kJ•mol-1;
(2)根据平衡常数结合三行式计算平衡浓度;
(3)存在的微粒有A2-、HA-、H-、OH-,则H2A第一步电离是完全的;
(4)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=2×10-11,Ksp[Cu(OH)2]=c(Cu2+)×c2(OH-)=2×10-20,据此计算;
(5)根据电荷守恒分析;呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,以此计算.
解答 解:(1)①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
依据盖斯定律计算,①×2+②+③,得到总反应的热化学方程式:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol;
故答案为:-246.4kJ/mol;
(2)2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol•L-1):0.44 0.6 0.6
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.44-2x 0.6+x 0.6+x
K=$\frac{(0.6+x)^{2}}{(0.44-2x)^{2}}$,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,故答案为:0.04mol•L-1;
(3)存在的微粒有A2-、HA-、H-、OH-,则H2A第一步电离是完全的,第一步电离方程式为H2A=H++HA-,故答案为:H2A=H++HA-;
(4)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=2×10-11,Ksp[Cu(OH)2]=c(Cu2+)×c2(OH-)=2×10-20,此时溶液中镁离子和铜离子浓度之比是$\frac{2×1{0}^{-20}}{2×1{0}^{-11}}$=1×10-9,故答案为:1×10-9;
(5)由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),已知溶液中c(CH3COO-)═c(Na+),则c(H+)=c(OH-),即溶液显中性;呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,所以用含a的代数式表示CH3COOH的电离常数Ka=$\frac{1{0}^{-7}×0.005}{\frac{a}{2}-0.005}$=$\frac{1{0}^{-9}}{b-0.01}$.
故答案为:$\frac{1{0}^{-9}}{b-0.01}$.
点评 本题侧重学生分析能力及计算能力的考查,涉及盖斯定律的应用、弱电解质的电离、Ksp的计算以及电荷守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
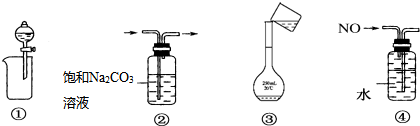
| A. | ①分离出BaSO4浊液中的BaSO4 | B. | ②除去CO2中少量HCl气体 | ||
| C. | ③将溶液转移到容量瓶中 | D. | ④排水法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂质所选用的试剂或操作方法 |
| A | Mg | Al | 加入过量盐酸溶液,充分反应,过滤 |
| B | NaHCO3溶液 | Na2CO3溶液 | 加入足量氢氧化钡溶液,充分反应,过滤 |
| C | NO | NO2 | 通过盛有水的洗气瓶,再干燥 |
| D | FeCl3溶液 | FeCl2溶液 | 加入过量的铁粉,充分反应,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com