
| A、能全部透过半透膜 |
| B、用激光笔照射有光亮的“通路” |
| C、所得溶液一定能导电 |
| D、所得物质一定为悬浊液或乳浊液 |


科目:高中化学 来源: 题型:
| A、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 | ||
| C、pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 | ||
D、向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH稀溶液分别与稀盐酸和稀醋酸反应生成1 mol H2O,放出热量相同 |
| B、稀盐酸分别与NaOH稀溶液和稀氨水反应生成1 mol H2O,放出热量相同 |
| C、Ba(OH)2稀溶液分别与稀盐酸和稀硫酸反应生成1 mol H2O,放出热量不同 |
| D、该反应说明有水生成的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸热反应在一定条件下也可以发生 |
| B、需要加热才能发生的反应不一定是吸热反应 |
| C、反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
| D、放热反应在常温下一定很容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol?L-1 |
| B、1 mol Zn与足量的该硫酸反应生成2g氢气 |
| C、该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol?L-1 |
| D、向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
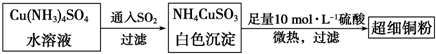
| 2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com