
| ||
| ||
| ||
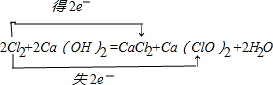 ,
,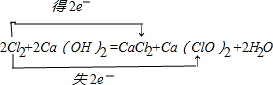 ;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;

科目:高中化学 来源: 题型:
| A、298K,反应③的△H3═+47.3 kJ?mol-1 |
| B、平衡时,其他条件不变,升高温度,反应①中正反应速率加快 |
| C、平衡时,其他条件不变,增大NO2浓度可增大反应③中SO2转化率 |
| D、反应③中,每有1mol O=O键断裂,同时生成2molSO3,则该反应达平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石>碳化硅>晶体硅 |
| B、氧化铝>氯化钾>氯化钠 |
| C、H2O>NH3>PH3>AsH3 |
| D、SiC>生铁>纯铁>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ |
| Ⅱ |
| Ⅲ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com