
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 生成氢气体积(ml) | 50 | 150 | 300 | 380 | 410 |
分析 Ⅰ.(1)根据各时间段生成氢气的体积判断反应速率大小;
(2)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响生成氢气的总量;
Ⅱ.(3)同一周期,从左到右,元素金属性逐渐减弱;
(4)金属性越强,单质与水反应越剧烈;
(5)钠与水反应生成氢氧化钠和氢气;
(6)反应现象不明显,说明反应速率小,根据影响速率的因素分析.
解答 解:Ⅰ.(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、100mL、150mL、80mL、30mL,由此可知反应速率最大的时间段为2~3 min,故答案为:2~3 min;
(2)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确;
B.加入NaCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;
C.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故C错误;
故答案为:C;生成NO气体,影响生成氢气的量;
Ⅱ.(3)同一周期,从左到右,原子失电子能力减弱,则元素金属性逐渐减弱;
故答案为:逐渐减弱;
(4)属性K>Na>Mg>Al,金属性越强,单质与水反应越剧烈,故反应最剧烈的烧杯是d,
故答案为:d;
(5)钠与水反应生成氢氧化钠和氢气,则钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(6)反应现象不明显,说明反应速率小,升高温度可以加快速率,所以把冷水换为热水,把水换为盐酸增大了溶液中氢离子的浓度,可以加快速率.
故答案为:BC.
点评 本题考查了物质性质实验方案的设计,侧重于学生的分析能力和实验能力的考查,本题将元素及其化合物、元素周期律与实验知识结合起来,具有较强的综合性,本题注意把握影响化学反应速率的因素,难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.0142 |
| NO2 | 0.100 | 0.0716 |
| A. | 平衡时,Ⅰ、Ⅱ中反应的转化率α(N2O4)>α(NO2) | |
| B. | 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) | |
| C. | 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=$\frac{Ⅰ}{K(Ⅱ)}$ | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 结论 | 原因 |
| A | 将氯气通入H2O2和NaOH的混合溶液中,导管口处发出红光,产生大量的气泡 | 该反应是放热反应,H2O2显示氧化性 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的Ksp小 |
| C | 在BaCl2和氨水混合溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
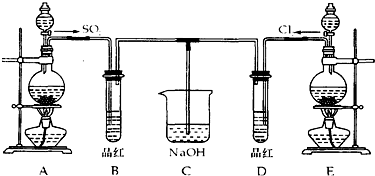
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
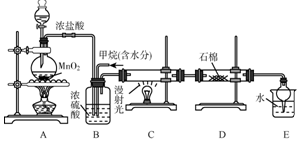 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com