
【题目】不能说明氧的非金属性比硫强的事实是( )
A. H2O的热稳定性强于H2S
B. 硫化氢水溶液露置于空气中变浑浊
C. H2O是液体,H2S常温下是气体
D. 氧气和氢气化合比硫和氢气化合容易
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
(1) X、Y、Z的第一电离能从大到小的顺序是___________(用元素符号表示,下同)。
(2)写出W的价电子排布式_____________,W同周期的元素中,与W原子最外层电子数相等的元素还有____________。
(3)根据等电子体原理,可知化合物XZ的结构式是__________, YZ2-的VSEPR模型是___________。
(4) X、Y、Z的.简单氮化物的键角从大到小的顺序是_______(用化学式表示),原因是________________
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式___________,该物质硬度大,推测该物质为_________晶体。其中Y元素的杂化方式是______。
(6)U的晶体属立方晶系,其晶胞边长为405pm ,密度是2.70g/cm3,通过计算确定其晶胞的类型_____(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
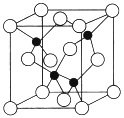
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体之间结构相似、物理性质也相近.根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是( )
A. CO32-和NO3- B. O3和SO2
C. CO2和NO2- D. SCN-和N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如右图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-![]() Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
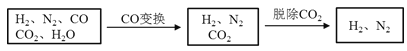
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
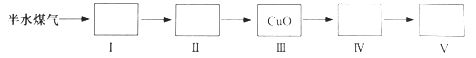
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com