
| A.用SO2漂白纸浆和草帽辫 |
| B.用氯化铁溶液腐蚀印刷线路板上的铜膜 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.高温下用焦炭还原SiO2制取粗硅 |
科目:高中化学 来源:不详 题型:单选题
| A.HCl+NaOH=NaCl+H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
| C.HCl+AgNO3=AgCl↓+HNO3 |
| D.MnO2+4HCl(浓)=MnCl2+C12↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe(OH)3+3HNO3═Fe(NO3)3+3H2O | ||||
| B.Ca(ClO)2+CO2+H2O═CaCO3+2HClO | ||||
| C.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | ||||
D.CaCO
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2S+FeS+SO2 则下列说法正确的是
Cu2S+FeS+SO2 则下列说法正确的是 | A.CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | B.每生成1molSO2转移6mol电子 |
| C.SO2既是氧化产物又是还原产物,FeS只是还原产物 | D.每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )A.若某温度下,反应后 =11,则溶液中 =11,则溶液中 = = |
| B.参加反应的氯气的物质的量等于0.5amol |
C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol≤ne≤ amol amol |
D.改变温度,产物中KC1O3的最大理论产量为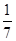 amol amol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
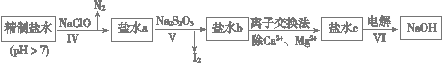
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com