
����Ŀ���ظ���أ�K2Cr2O7����Ƥ����ӡȾ��ѧ����Ƶȷ���Ӧ�ù㷺���ش��������⣺
��1���Ƽ�����Σ����ᰲȫ�����ڲⶨ�Ƿ����Ƶķ������ظ���ط�����Һ�ɳȺ�ɫ��Ϊ��ɫ��Cr3+��������Ѿ����ơ�д���ظ���ط��������Ƶ����ӷ���ʽ��___________________________��
��2���ø�����FeOCr2O3����Al2O3���ʣ�Ϊԭ���Ʊ��ظ���صĹ��գ�
��֪��i. 2CrO42��+2H+ ![]() Cr2O72��+H2O��
Cr2O72��+H2O��
ii�����£�Ksp[Al��OH��3]��1.3��10��33��
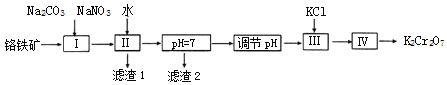
iii���й����ʵ��ܽ��������ͼ��
��������������ͼ�еIJ���I����Ҫ��ӦΪ��2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2��+7NaNO2������һ����Ӧ�Ļ�ѧ����ʽ��__________��
4Na2CrO4+Fe2O3+4CO2��+7NaNO2������һ����Ӧ�Ļ�ѧ����ʽ��__________��
������2�ijɷ���_____��д��ѧʽ�������£���Һ�У�c��Al3+����_____molL��1
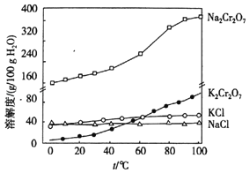
�۹�������ͼ�У�����������pH����������_________________________________��
�ܲ�������KCl��Ŀ����________________________________________��ʵ�����У�����IV�õ��IJ��������оƾ��ơ��ձ���___________________��
���𰸡�2Cr2O72��+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O Al2O3+Na2CO3![]() 2NaAlO2+CO2�� Al��OH��3 1.3��10��12 CrO42��ת��ΪCr2O72�� ʹNa2Cr2O7ת��ΪK2Cr2O7 ©������������
2NaAlO2+CO2�� Al��OH��3 1.3��10��12 CrO42��ת��ΪCr2O72�� ʹNa2Cr2O7ת��ΪK2Cr2O7 ©������������
��������
��1���Ҵ����л�ԭ�ԣ�������Ϊ����ظ���ؾ��������ԣ���Ԫ�ش������۽���Ϊ�����ۣ����ݵ�ʧ��������ȣ������غ���ƽ����ʽ��
��2��������ͨ�����գ�2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2��+7NaNO2��Al2O3+Na2CO3
4Na2CrO4+Fe2O3+4CO2��+7NaNO2��Al2O3+Na2CO3![]() 2NaAlO2+CO2���õ�Na2CrO4��Fe2O3��MgO��NaAlO2�Ļ����ϵ��Ȼ���ˮ�ܽ⣬���˷��룬�õ�����Fe2O3����Һ�к���Na2CrO4��NaAlO2���ٵ�����Һ��pH��ʹƫ��������ȫת��Ϊ�����������������˷��룬��Һ��������pHֵ��ʹ�� CrO42��ת��ΪCr2O72�� �������Ȼ���ʹNa2Cr2O7ת��ΪK2Cr2O7����������Ũ������ȴ�ᾧ�����˵ķ����õ�K2Cr2O7���壬�ݴ˽��з�����
2NaAlO2+CO2���õ�Na2CrO4��Fe2O3��MgO��NaAlO2�Ļ����ϵ��Ȼ���ˮ�ܽ⣬���˷��룬�õ�����Fe2O3����Һ�к���Na2CrO4��NaAlO2���ٵ�����Һ��pH��ʹƫ��������ȫת��Ϊ�����������������˷��룬��Һ��������pHֵ��ʹ�� CrO42��ת��ΪCr2O72�� �������Ȼ���ʹNa2Cr2O7ת��ΪK2Cr2O7����������Ũ������ȴ�ᾧ�����˵ķ����õ�K2Cr2O7���壬�ݴ˽��з�����
��1������������ԭ��Ӧ�л��ϼ�������ȣ������غ㣬д�����ӷ���ʽΪ2Cr2O72��+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O��
�𰸣�2Cr2O72��+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O��
��2����Al2O3��Ϊ���������Ҳ���Ժʹ����ڸ��������·�Ӧ����ƫ�����ƺͶ�����̼������ʽΪAl2O3+Na2CO3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
�𰸣�Al2O3+Na2CO3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
����Һ�к���Na2CrO4��NaAlO2��������Һ��pH=7��ʹƫ��������ȫת��Ϊ�����������������˷��룻����Ksp[Al��OH��3]��1.3��10��33=c��Al3+����c��OH-��3����c��Al3+��=![]() = 1.3��10��12��
= 1.3��10��12��
�𰸣�Al��OH��3 ��1.3��10��12��
������2CrO42��+2H+ ![]() Cr2O72��+H2O��֪������������pH����������ʹ CrO42��ת��ΪCr2O72����
Cr2O72��+H2O��֪������������pH����������ʹ CrO42��ת��ΪCr2O72����
�𰸣�CrO42��ת��ΪCr2O72����
��������������KCl��Ŀ����ʹNa2Cr2O7ת��ΪK2Cr2O7����������Ũ������ȴ�ᾧ�����˵ķ����õ�K2Cr2O7���壬���ò��������оƾ��ơ��ձ���©������������
�𰸣�ʹNa2Cr2O7ת��ΪK2Cr2O7��©������������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������е�һ����Ҫ��Ӧ��SO2��400-500��ͳ�ѹ�µĴ�����: 2SO2 + O2![]() 2SO3, ����һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н���,�������˵���д������
2SO3, ����һ������Ӧ���ȵĿ��淴Ӧ�������Ӧ���ܱ������н���,�������˵���д������
A.��Ӧ�¶�ѡ��400-500���Ǹ÷�Ӧ�����Ĵ����ԡ���Ӧ���ʡ���Ӧ�ȵȽǶ��ۺϿ��ǵĽ��
B.��Ϊ�ڳ�ѹ�¸÷�Ӧ�����ʺ�SO2��ת�����Ѿ��ܸ��ˣ�����ѡ��ѹ������Ҫ�Ǵ������ɱ��Ƕȿ���
C.Ϊ���SO2��ת����,Ӧ�ʵ����O2��Ũ��
D.ʹ�ô�����Ϊ�˼ӿ췴Ӧ����,���SO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������14.4 g CO��CO2�Ļ�����壬�ڱ�״������ռ�����ԼΪ8.96 L���ش��������⣺
(1)�û�������ƽ��Ħ��������_________________________��
(2)���������̼ԭ�ӵĸ�����_________________________
(��NA��ʾ�����ӵ�������ֵ)��
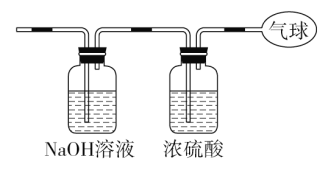
(3)�������������ͨ����ͼװ�ã�����ռ��������С�
���������ռ���������Ħ��������_______________________��
��������������ռ�������������Ϊ___________________��
���������ռ���������ĵ�������Ϊ_____________________
(��NA��ʾ�����ӵ�������ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.������Ũ�Ⱦ�Ϊ0.1 mol/L������Ͱ�ˮ��ϳ�����ʱ�����������������ڰ�ˮ
B.��������0.1 mol/L��ˮ�м����Ũ�ȵ���������ᣬ��Һ����������ǿ
C.������pH��ȵ�CH3COOH��Һ�������У�c(OH-)���
D.������pH=1��CH3COOH��Һ��pH=13��NaOH��Һ�У�c(CH3COO-)=c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������·�Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-764.5kJ��mol-1���ﵽƽ���Ϊ��߷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ�ǣ� ��
N2(g)+2CO2(g) ��H=-764.5kJ��mol-1���ﵽƽ���Ϊ��߷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ�ǣ� ��
A.�Ӵ���ͬʱ�����¶�
B.�����¶�ͬʱ���뵪��
C.�Ӵ���ͬʱ����ѹǿ
D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӱ͵�������ȡ����ζ���л���R���ṹ��ʽ��ͼ��ʾ�������й�R��˵���������
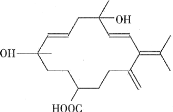
A.R������̼��������Һ��Ӧ��������������Ӧ
B.R�ܷ����������ӳɡ�������Ӧ
C.R���ǻ�����ͭ��������������O2��Ӧ����ȩ��
D.R�ķ���ʽΪC21H32O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��������ԭҺ�������һ��������ɫ�Ķ��ε�ء��乤��ԭ����ͼ��ʾ������������ȷ����

A.������Y�������������ӽ���Ĥ��X��
B.�ŵ�����У��������ҺpH����
C.Y����ӦʽΪV2��-e-��V3��
D.ÿת��1 mol��������������2 mol H���ɽ���Ĥ�Ҳ������Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��a��b��c��d��e��ԭ��������������a�ļ�������������Ӿ�����ͬ�ĵ��Ӳ�ṹ��bԭ�����������������ڲ��������2����d�ĵ�����ϡ������ҷ�Ӧ�ų�a2����1L0.2mol��L-1a2e��ˮ��Һ�л���ͨ��ec2���壬����Һ��pH��ec2�����������״�����Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
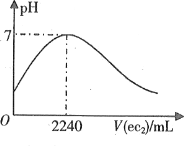
A.a��b�ɹ�������ԭ�ӹ�ƽ��ķ���
B.��b��c��e����̬�⻯���У�c�����ȶ�
C.d���Ȼ���һ�����ƻ�ˮ�ĵ���ƽ��
D.e����ۺ����������⻯����ܷ���������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�����Ư����ɱ������������������ˮ�Ͷ�����̼�����ʷ�����Ӧ�����治��ʱ���ױ��ʡ�ijʵ��С���Թ�������Ϊ�о��������������ʵ�顣
(1)̽��һ��Na2O2��Ʒ�Ƿ��Ѿ����ʣ�ȡ������Ʒ�������ܽ⣬����__________��Һ��������а�ɫ������֤��Na2O2�Ѿ����ʡ�
(2)��ʵ��С��Ϊ�˴��Բⶨ�������Ƶ�������������ȡ��m g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������
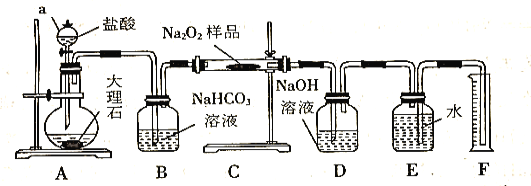
��װ��D��������_________________________________��
�ڽ��������Ӻ��Ժ�����еĵ�һ��������_________________________________��
��д��װ��C�з�����Ҫ��Ӧ�Ļ�ѧ����ʽ_________________________________��
�ܷ�Ӧ�������ڶ�ȡʵ����������������ʱ������Ϊ��������_______________(�����)��
a����ȡ�������ǰ������ȴ������
b��������ͲʹE��F��Һ��߶���ͬ
c�������밼Һ�����͵���ƽʱ��ȡ��Ͳ��ˮ�����
�ݶ�����Ͳ��ˮ�������������ɱ�״�������������ΪVmL������Ʒ�й������Ƶ���������Ϊ______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com