
 W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题: ,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).
,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).分析 W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,Y是地壳中含量最多的元素,则Y为O元素;M与Y同主族,则M为S元素,故G为Cl元素;G与Z形成的化合物是厨房常用的调味品,则Z为Na;X的简单气态氢化物水溶液呈碱性,则X为N元素.
(1)主族元素周期数=电子层、主族族序数=最外层电子数;X的简单气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小;
(2)元素非金属性越强,氢化物越越稳定;
(3)由 H、O、Na、S组成的两种盐(均含有以上四种元素)的溶液反应可产生SO2气体,应是亚硫酸氢钠与硫酸氢钠反应生成硫酸钠、二氧化硫与水;
(4)①A为电解池阴极,发生还原反应,水放出生成氢气与氢氧根离子;
②B电极为电解池阳极,发生氧化反应,氯离子放电生成氯气,用湿润的淀粉KI试纸检验;
(5)A.均属于分子晶体,相对分子质量越大沸点越大;
故A错误;
B.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,反应热=反应物总键能-生成物总键能,据此计算判断;
C.X4与X2都由同种元素构成的不同单质,二者为同素异形体;
(6)用N2H4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气,反应方程式为:2N2H4+2NO2═3N2+4H2O,计算生成4mol水蒸气放出的热量,注明聚集状态与反应热书写热化学方程式;
16g N2H4(g)的物质的量为$\frac{16g}{32g/mol}$=0.5mol,根据方程式计算出生成气态水放出的热量,气态水转化为液态水也放出热量,进而计算生成液态水放出的热量;
用N2H4、氧气与KOH溶液组成碱性燃料电池,负极上N2H4失电子发生氧化反应,碱性条件下生成氮气与水,电解质溶液中阴离子向负极移动.
解答 解:W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,Y是地壳中含量最多的元素,则Y为O元素;M与Y同主族,则M为S元素,故G为Cl元素;G与Z形成的化合物是厨房常用的调味品,则Z为Na;X的简单气态氢化物水溶液呈碱性,则X为N元素.
(1)M为S元素,原子核外有3个电子层,最外层电子数为6,故其处于第三周期ⅥA族;X的简单气态氢化物为NH3,电子式为 ;离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,故离子半径:为S2->Cl->O2->Na+>H+,
;离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,故离子半径:为S2->Cl->O2->Na+>H+,
故答案为:第三周期ⅥA族; ;S2->Cl->O2->Na+>H+;
;S2->Cl->O2->Na+>H+;
(2)由于非金属性O>S,故氢化物稳定性H2O>H2S,
故答案为:H2O;O的非金属性大于S;
(3)由 H、O、Na、S组成的两种盐(均含有以上四种元素)的溶液反应可产生SO2气体,应是亚硫酸氢钠与硫酸氢钠反应生成硫酸钠、二氧化硫与水,反应离子方程式为:HSO3-+H+═H2O+SO2↑,
故答案为:HSO3-+H+═H2O+SO2↑;
(4)如图1,A、B两极均为惰性电极,a是NaCl饱和溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:①A为电解池阴极,发生还原反应,水放出生成氢气与氢氧根离子,电极反应式为:2H2O+2e-═H2↑+2OH-,现象为:有气泡产生,且溶液呈红色,
故答案为:2H2O+2e-═H2↑+2OH-;有气泡产生,且溶液呈红色;
②B电极为电解池阳极,发生氧化反应,氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,用湿润的淀粉KI试纸,试纸变蓝,
故答案为:2Cl--2e-═Cl2↑;用湿润的淀粉KI试纸,试纸变蓝;
(5)A.X4沸点比P4(白磷)低,属于分子晶体,故A错误;
B.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故B正确;
C.X4与X2都由同种元素构成的不同单质,为同素异形体,故C正确.
故答案为:BC;
(6)用N2H4作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气,反应方程式为:2N2H4+2NO2═3N2+4H2O,已知生成1mol水蒸气时放热284kJ,则反应的热化学方程式为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ/mol,
16g N2H4(g)的物质的量为$\frac{16g}{32g/mol}$=0.5mol,由方程式可知生成水为0.5mol×2=1mol,已知H2O(l)═H2O(g)△H=+44kJ/mol,与NO2反应生成液态水时放出的热量是1136kJ/mol×$\frac{1}{4}$+1mol×44kJ/mol=328kJ,
用N2H4、氧气与KOH溶液组成碱性燃料电池,负极上N2H4失电子发生氧化反应,电极反应式为:N2H4-4e-+4OH-═N2↑+4H2O,电解质溶液中OH-离子向负极移动
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ/mol;328;2H4-4e-+4OH-═N2↑+4H2O;负.
点评 本题考查结构性质位置关系应用,涉及半径比较、元素周期律、原电池、电解池、热化学方程式书写及反应热计算、元素化合物推断等,推断元素是解题关键,注意对基础知识的理解掌握,难度中等.


科目:高中化学 来源: 题型:解答题

| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,A2+H2?2HA K=5.6×107 B2+H2?2HB K=43 | 非金属性:A>B |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
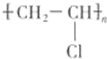 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
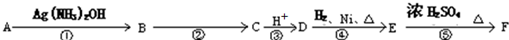
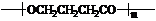 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的3个碳原子在一条直线上 | |
| B. | 在光照条件下能和氯气发生取代反应 | |
| C. | 分子中含有极性键和非极性键 | |
| D. | 丙烷和丁烷互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com