
下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2 H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.用石墨电极电解饱和食盐水:2 Cl-+2 H2O  2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3++2 I-===2 Fe2++I2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 可以用四氯化碳把溴水中的溴萃取出来,振荡静置分层后,下层液体为无色 | |
| B. | 萃取分液时,从分液漏斗下口流完下层液体,及时关闭.再打开流出上层液体 | |
| C. | 碘易溶于酒精,微溶于水,故可以用酒精萃取碘水中的碘 | |
| D. | 萃取之后,一般通过分液漏斗将互不相溶的液体分离 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。制取N2O的方法有很多,例如
①NH4NO3===N2O↑+2H2O
②K2SO3+2NO===K2SO4+N2O↑
③2NH3+2O2===N2O↑+3H2O
④2NaNO3+(NH4)2SO4===2N2O↑+Na2SO4+4H2O等。下列说法正确的是
A.反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物
B.反应②中K2SO3是还原剂,N2O是氧化产物
C.反应③中每生成1 mol N2O,转移8 mol电子
D.反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:简答题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。据此回答下列问题:
(1)L的常见原子组成符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用具体元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ,B的结构式为 。Z和L也能组成原子数目比2∶4的分子C, 已知1 mol 液态C和液态B燃烧时生成无毒无害物质,并释放524.5 kJ的热量,试写出该反应的热化学方程式为 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是 (填字母代号)。
A.+99.7 kJ·mol-1 | B.+29.7 kJ·mol-1 | C.-20.6 kJ·mol-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出阳极生成R的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列变化的实质相似的是( )
① 浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
② 二氧化硫和氯气均能使品红溶液褪色
③ 二氧化硫能使高锰酸钾溶液、溴水褪色
④ 氨气和碘化氢气体均不能用浓硫酸干燥
⑤ 常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥ 浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A.只有②③④ B.只有③⑤ C.只有③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:简答题
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
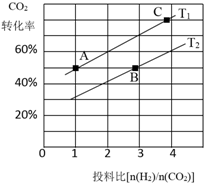 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.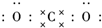 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
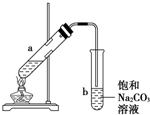 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 可将饱和碳酸钠溶液换成氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com