
下列溶液中,一定能大量共存的离子组是
A.能使氢氧化铝迅速溶解的溶液: Na+、Fe2+、NO3— 、SO42—
B.能使酚酞试液变红的溶液: Na+、NH4+、 CO32—、SO42—
C.含有大量SO42—的透明溶液: K+ 、Cu2+ 、Cl—、NO3—
D.含有大量ClO—的溶液: H+、 Mg2+、I—、SO42—
C
【解析】
试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中能使氢氧化铝迅速溶解的溶液可能显酸性,也可能显碱性。显碱性Fe2+不能大量共存;显酸性,在酸性条件下Fe2+与NO3—之间发生氧化还原反应,不能大量共存。B中能使酚酞试液变红的溶液显碱性,则NH4+不能大量共存;D中ClO-能氧化I-,不能大量共存,答案选C。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。


科目:高中化学 来源: 题型:阅读理解
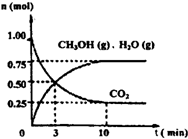 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.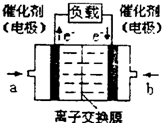
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,CuS的溶解度大于ZnS的溶解度 | B、除去工业废水中的Cu2+,可以选用FeS做沉淀剂 | C、足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol/L | D、在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com