
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
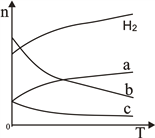
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
【答案】 +90.4 kJ/mol 放热 C2H4或乙烯 增大压强;或在压强不变的条件下减小n(CO2):n(H2)的投料比(即增加H2的浓度);或及时分离产物(如分离出水) AD 0.33 mol/L (2×10-9)/(a-0.02)
【解析】(1)①2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
②2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
由③+①-②得2H2(g)+SO2(g)![]() S(g)+2H2O(g),则ΔH4=ΔH3+ΔH1-ΔH2=-483.6kJ·mol-1+8.0 kJ·mol-1-(-566.0 kJ·mol-1)=+90.4 kJ/mol。
S(g)+2H2O(g),则ΔH4=ΔH3+ΔH1-ΔH2=-483.6kJ·mol-1+8.0 kJ·mol-1-(-566.0 kJ·mol-1)=+90.4 kJ/mol。
(2)①由图像可知,当温度升高时,平衡混合物中氢气的物质的量增加,所以升高温度,化学平衡向逆反应方向移动,故该反应为放热反应。
②因为起始时,按n(CO2):n(H2)=1:3投料,故在平衡混合物中,C2H4与H2O的物质的量之比为1:4.由曲线的变化趋势可知,曲线a表示的物质是CO2,则曲线c表示的物质为C2H4(或乙烯)。
③为提高CO2的平衡转化率,除改变温度外,因为正反应是气体分子数减少的反应,故还可采取的措施是增大压强;或在压强不变的条件下减小n(CO2):n(H2)的投料比(即增加H2的浓度);或及时分离产物(如分离出水)。
④恒温恒容下,A.压强是变量,容器内的压强不发生变化,表明反应达到平衡;B.混合气体的密度一直不发生变化,故不能根据密度判断平衡状态;C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4,不能说明各组分的浓度保持不变;D.单位时间内生成6molH2、同时生成4 molH2O,表明正反应速率和逆反应速率相等。综上所述,能够说明该反应已达到平衡的是AD;
(3)6.99gBaSO4固体的物质的量为0.03mol,将其完全转化为BaCO3,需要消耗0.03mol Na2CO3. BaSO4完全溶解于1 L Na2CO3溶液后,c(SO42-)=0.03mol/L,则此溶液中c(Ba2+)不大于![]() mol/L,由此计算出该溶液中,c(CO32-)至少为
mol/L,由此计算出该溶液中,c(CO32-)至少为 。因此,欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,所用的Na2CO3溶液的物质的量浓度至少为
。因此,欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,所用的Na2CO3溶液的物质的量浓度至少为![]() 0.33 mol/L。
0.33 mol/L。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则c(OH-)=1×10-7mol/L,根据电荷守恒可知,c(NH4+)=c(Cl-)=0.5![]() 0.02 mol·L-1=0.01 mol·L-1,由物料守恒得c(NH3H2O)=(0.5a-0.01) mol·L-1,则氨水的电离平衡常数Kb=
0.02 mol·L-1=0.01 mol·L-1,由物料守恒得c(NH3H2O)=(0.5a-0.01) mol·L-1,则氨水的电离平衡常数Kb= ![]() (2×10-9)/(a-0.02)。
(2×10-9)/(a-0.02)。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=![]() ,它所对应的化学反应为:__________________。
,它所对应的化学反应为:__________________。
(2)已知在一定温度下,
①C(s)+CO2(g)![]() 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。
(4)高炉炼铁产生的废气中的![]() 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和![]() 反应制备甲醇:
反应制备甲醇: ![]() 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 |
| 能量变化( |
甲 | 1 |
|
| 放出 |
乙 | 1 |
|
| 放出 |
丙 | 2 |
|
| 放出 |
则下列关系正确的是__________。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
e.该反应若生成1![]()
![]() ,则放出(
,则放出(![]() 热量
热量
②若在一体积可变的密闭容器中充入1![]()
![]() 、2
、2![]()
![]() 和1
和1![]()
![]() ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的系统命名法为2, 5-二甲基-4乙基己烷
的系统命名法为2, 5-二甲基-4乙基己烷
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
D.可用石蕊落液来鉴别乙二醇、葡萄糖、乙酸的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各小题。
(1)铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。
①写出赤铁矿主要成分的化学式___________________;
②红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其化学反应方程式为_______;
(2)写出除去下列气体中的杂质(括号内的气体为杂质)所用的试剂,并写出除杂的化学方程式。
CO2 (HCl) ______________;化学方程式:_________________。
(3)1774年,瑞典化学家舍勒在研究软锰矿的过程中,制备出了一种黄绿色、有刺激性气味的气体。舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。写出实验室制取氯气的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为符合实验安全要求的是( )
A.酒精灯着火时用湿抹布熄灭
B.冷凝管中的水流方向是从上口进入,下口排出
C.将鼻孔凑到集气瓶口闻气体的气味
D.发现家中天然气泄漏,立即打开抽油烟机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3- 。
回答下列问题:
(1)仪器a名称:________。
(2)B瓶内装的物质是:____。
(3)若NO能被Na2O2完全吸收,E装置中的现象为___________________________。
(4)三颈烧瓶A中反应的化学方程式为_____________________________。
(5)C装置的作用是_____________________________________。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)现有已制得SO2的饱和溶液,请设计一个简单实验,比较SO2与Fe2+ 还原性的
强弱(可供选择的试剂有:SO2的饱和溶液、FeCl2溶液、氯水、FeCl3溶液、KSCN
溶液、Ba(NO3)2溶液、BaCl2溶液)【要求:简要写出实验步骤、现象和结论】_________________________________________________________________。
(7)某同学测定部分变质的Na2SO3样品样品中Na2SO3的含量(已知在酸性条件下IO3-能将SO32-氧化为SO42-,自身还原为I-):
①用电子天平称取16.00g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液(硫酸酸化)滴定,三次平行实验测得标准液的体积为24.00mL。则滴定终点时锥形瓶中产生的现象为________________________,写出与产生终点现象有关反应的离子方程式________________________________,样品中Na2SO3的质量分数为_________。(计算结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)写出下列有机物的键线式: 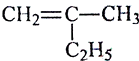
(2)写出有机物  的名称
的名称
(3)写出甲基电子式: , 乙炔的结构式
(4)某有机高分子化合物的结构片段如下:
则合成它的单体是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2B 在水溶液中存在下列关系:H2B=H++HB-,HB-![]() H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
A. 电离方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或碱性
C. NaHB 和NaOH 溶液反应的离子方程式:HB-+OH-= H2O+B2-
D. 该溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面说法中,与盐类水解无关的是( )
①NaHCO3做发酵粉时加入柠檬酸后效果更好
②FeCl2溶液中加入一定量的铁粉
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4F溶液不能保存在玻璃试剂瓶中
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧室温下NaHCO3饱和溶液pH约为8.4
⑨0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L
A. ②⑧ B. ①② C. ④⑧ D. 全有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com