
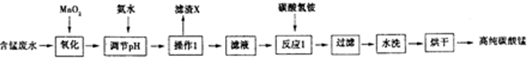
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
分析 (1)加入MnO2,做氧化剂,氧化Fe2+;
(2)根据表中数据可知,氢氧化铝完成沉淀的pH为5.2,氢氧化铁完全沉淀的pH为3.7,所以调节pH在5.2,
(3)调节pH在5.2,Fe3+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在,滤液中的溶质为MnSO4、(NH4)2SO4;
(4)NH4HCO3与MnSO4生成CO2、MnCO3、(NH4)2SO4和H2O;
(5)MnCO3沉淀中附有SO42-,通过检验沉淀中是否含有SO42-,来确定沉淀洗涤干净与否;
(6)碳酸锰溶于强酸生成Mn2+、CO2和H2O.
解答 解:(1)加入MnO2,做氧化剂,氧化Fe2+,离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)根据表中数据可知,氢氧化铝完成沉淀的pH为5.2,氢氧化铁完全沉淀的pH为3.7,所以调节pH在5.2,
故答案为:5.2;
(3)调节pH在5.2,Fe3+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在,即滤渣的成分为:Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4;
故答案为:Fe(OH)3、Al(OH)3;MnSO4、(NH4)2SO4;
(4)NH4HCO3与MnSO4生成CO2、MnCO3、(NH4)2SO4和H2O,化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O;
故答案为:2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O;
(5)MnCO3沉淀中附有SO42-,通过检验沉淀中是否含有SO42-,来确定沉淀洗涤干净与否,取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净;
故答案为:取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净;
(6)碳酸锰溶于强酸生成Mn2+、CO2和H2O,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O;
故答案为:MnCO3+2H+=Mn2++CO2↑+H2O.
点评 本题考查了铁盐和亚铁盐的相互转变、常见离子的检验方法、难溶电解质的溶解平衡及离子方程式的书写,题目难度中等,解题关键是合理分析题中生成流程及表中离子完全沉淀时的数据的含义,试题培养了学生分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
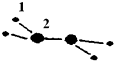 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: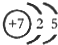 .
.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N=O | C≡O | C=O | N≡N |
| 键能(kj/mol) | 632 | 1072 | 750 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
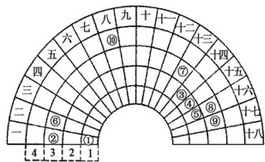 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ③⑥⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL3 mol/L的X溶液 | B. | 20℃30mL2 mol/L的X溶液 | ||
| C. | 20℃10mL4 mol/L的X溶液 | D. | 10℃20mL2 mol/L的X溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com