
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
| ||
| ||
| 0.04mol |
| 2 |
| 0.224L |
| 22.4L/mol |
| ||
| 0.4L |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓ |
| B、稀硝酸中加入少量碳酸亚铁:FeCO3+2H+→Fe2++CO2↑+H2O |
| C、硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-═H2O |
| D、饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O═2NaHCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白云石的化学式为2CaCO3?MgCO3 |
| B、残留固体的质量为14.4g |
| C、取13.8g该白云石与足量盐酸完全反应,最多收集到标准状况下的CO22.24L |
| D、27.6g白云石与过量盐酸完全反应,可消耗HCl0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.尿素是一种氮肥,溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是
Ⅰ.尿素是一种氮肥,溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 编号 |
物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 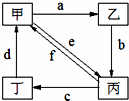 |
Cu | CuO | CuSO4 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | CH3CH2Cl | C2H5OH | CH2=CH2 | CH3CH3 |
| A、①②③④ | B、①②③ |
| C、①③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、无色澄清透明溶液中:H+、Cu2+、S
| ||||
B、与铝反应放出H2的溶液中:NH4+、K+、N
| ||||
C、滴加酚酞显红色有溶液中:Na+、ClO-、S2-、S
| ||||
D、由水电离的c(OH-)=10-13mol?L-1的溶液中:Na+、Cl-、C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A、由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |||||||||||
| B、氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |||||||||||
| C、表中②组反应的还原产物是KCl,转移6e- | |||||||||||
D、表中③组反应的离子方程式为2Mn
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com