
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
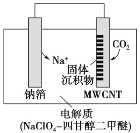
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
【答案】D
【解析】
A. 根据4Na+3CO2=2Na2CO3+C,得出负极为Na,正极为多壁碳纳米管(MWCNT),则电流流向为 MWCNT→导线→钠箔,故A正确;
B. 放电时,正极是CO2得到电子变为Na2CO3,其电极反应式为 3CO2+4Na++4e-=2Na2CO3+C,故B正确;
C. 选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发,故C正确;
D. 原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,负极质量减少0.2 mol×23 gmol1 = 4.6g,正极3CO2+4Na++4e-=2Na2CO3+C,生成0.1mol碳酸钠和0.05mol碳,正极质量增加0.1mol×106 gmol1+ 0.05mol×12 gmol1=11.2,因此两极的质量差为 11.2 g+4.6g = 15.8g,故D错误。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】(9分)
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
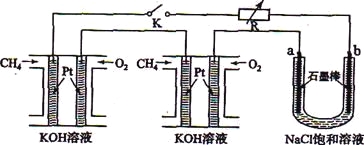
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为_____,干燥管D的作用为__________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有______溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_____________________。
(3)YX4M的电子式为___________________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为___________________________________。
(4)X、Z两元素形成的原子个数比为1∶1的化合物的结构式____________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—F是几种典型有机代表物的分子模型,请看图回答下列问题。
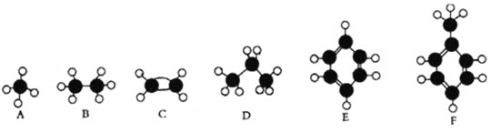
(1)常温下含碳量最高的是________(填对应字母);
(2)一卤代物种类最多的是 ___________(填对应字母);
(3)A、B、D三种物质的关系为____________________________________
(4)F中一定在同一个平面的原子数目为_____________________
(5)写出C使溴水褪色的方程式 ___________
(6)写出E发生溴代反应的化学方程式______________________________;
(7)写出C的官能团的名称______________________
(8)F的二溴取代产物有_____________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在Y电板(铁电极)质量减小2.8g,在Y极收集到气体为1.68 L 则X极收集到气体__________L(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:

(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
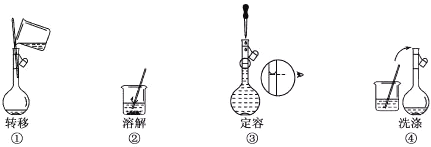
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:

根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com