
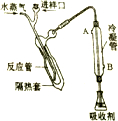
 “凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下:
“凯氏定氮法”测得奶粉中蛋白质含量是由丹麦人约翰•凯达尔发现的.其原理是用强酸处理蛋白质样品,让样品中的氮元素释放出来,通过测得氮的含量,再乘以系数6.38,即为蛋白质含量.凯氏定氮法步骤如下: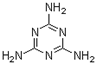 )
) 分析 凯氏定氮法测定奶粉中蛋白质含量原理为:通过样品处理把氮元素转化为NH4+,加入氢氧化钠转化为氨气,用吸收剂吸收,用盐酸滴定,通过消耗盐酸的量来计算氮元素的含量和蛋白质的含量.
(1)从测量步骤可知样品处理目的是把蛋白质中氮元素转化为NH4+;
(2)铵根离子与氢氧根离子反应生成氨气;冷凝水与蒸汽的流向相反时冷却效果好;根据氨气的性质分析;
(3)样品中释放出来的N元素全部归为蛋白质中的N元素,而样品中释放出来的N元素也可能不是从蛋白质中来的;
(4)A.三聚氰胺(  )含氮量高;
)含氮量高;
B.样品入口未用蒸馏水冲洗,会损失氮元素;
C.第①步定容时俯视刻度线,读数偏小;
D.滴定开始时仰视读数,滴定终点时俯视读数,盐酸读数偏小.
解答 解:(1)蛋白质中的氮元素不容易测定,从测量步骤可知样品处理目的是把蛋白质中氮元素转化为NH4+;
故答案为:将奶粉中氮元素全部转变为NH4+;
(2)铵根离子与氢氧根离子反应生成氨气,则碱化蒸馏时反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;冷凝水与蒸汽的流向相反时冷却效果好,所以冷凝水从B口进入,从A口流出;根据氨气的性质分析;氨气的水溶液显碱性,取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性),则证明氨全部被水蒸出并进入锥形瓶;
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;B;取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性);
(3)测定原理为:把蛋白质样品用中的氮元素释放出来,通过测定氮元素的质量从而换算出蛋白质的含量,此方法的局限性很明显,它把样品中释放出来的N元素全部归为蛋白质中的N元素,若样品中含有其他含氮化合物,则无法准确测定蛋白质的含量,
故答案为:无法确定氮元素是否一定来自于蛋白质;
(4)A.三聚氰胺(  )含氮量高,会使计算结果中蛋白质含量值“增加”,故A符合;
)含氮量高,会使计算结果中蛋白质含量值“增加”,故A符合;
B.样品入口未用蒸馏水冲洗,损失了氮元素,会使计算结果中蛋白质含量值偏低,故B不符合;
C.第①步定容时俯视刻度线,读数偏小,则溶液体积偏小,根据c=$\frac{n}{V}$,会使计算结果中蛋白质含量值“增加”,故C符合;
D.滴定开始时仰视读数,滴定终点时俯视读数,盐酸读数偏小,会使计算结果中蛋白质含量值偏低,故D不符合;
故答案为:AC.
点评 本题考查了蛋白质中含氮量测定方法,题目难度中等,试题涉及了元素化合物的性质、实验原理、物质检验等,侧重考查学生对实验方案理解及对元素化合物的知识的应用能力.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
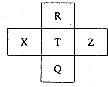 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )| A. | X元素的最高价氧化物对应的水化物酸性强于T元素 | |
| B. | 原子半径:R<T<Z | |
| C. | Z的单质可从T的气态氢化物中置换出T的单质 | |
| D. | R、T、Q最高正价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2和CO浓度比 | B. | 混合气体的密度 | C. | 转化率 | D. | CO 的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| B. | 苯、甲苯、二甲苯互为同系物,均能使酸性高锰酸钾溶液褪色 | |
| C. | 等质量的苯、乙炔、乙烯和甲烷分别在氧气中充分燃烧,所消耗的氧气的量依次增加 | |
| D. | 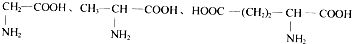 三种氨基酸之间脱水,最多可生成6种二肽 三种氨基酸之间脱水,最多可生成6种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |

| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com