
【题目】一种热激活电池可用作导弹、火箭的工作电源。热激活电池中作为电解质的固体LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb,下列有关说法正确的是( )

A.负极反应式:PbSO4+2e-+2Li+==LiSO4+Pb
B.放电过程中,电流由钙电极流向硫酸铅电极
C.室温下,电池工作每转移0.1mol电子,理论上生成10.35gPb
D.放电过程中,Cl-向负极移动
【答案】D
【解析】
原电池工作时,正极得电子化合价降低,发生还原反应;负极失电子化合价升高发生氧化反应;电池内电路:阳离子向正极移动,阴离子向负极移动;外电路:电子由负极流向正极;
A.原电池的正极为PbSO4电极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,故A错误;
B.放电过程中,Ca被氧化生成CaCl2,为原电池的负极,PbSO4发生还原反应,为原电池的正极,电流由硫酸铅电极流向钙电极,故B错误;
C.电解质熔融状态下,由电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb可知每转移0.1mol电子,理论上生成0.05molPb,生成Pb的质量为207×0.05g=10.35g,但常温下,电解质不是熔融态,离子不能移动,不能产生电流,故C错误;
D.放电时,内电路中,阳离子向正极移动,阴离子向负极移动,即Cl-向负极移动,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】一定温度下,将1.0 mol的HI(g)通入体积为1.0 L的密闭容器中,实验测得HI(g)的最大分解率为22.2%,则该温度下,反应![]() H2(g) +
H2(g) +![]() X2(g)
X2(g)![]() HX(g)平衡常数接近于( )
HX(g)平衡常数接近于( )
A.0.02B.0.15C.7D.49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是
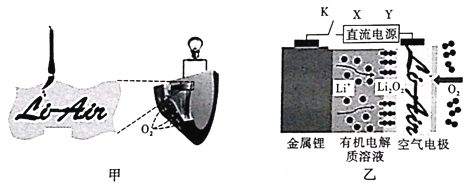
A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(K2NCONH2)的化学能直接转化为电能,并生成对环境无害物质的装罝;同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. H+透过质子交换膜由右向左移动
B. 铜电极应与X相连接
C. M电极反应式:H2NCONH2+H2O-6e-== CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铁电极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可燃冰是另一种CH4的重要来源,利用可燃冰制备的甲烷可以设计成如下燃料电池,可以作为“移动的发电厂”,源源不断的对外供电,下列说法错误的是

A.a电极通入甲烷气体,作负极
B.每通入1mol CH4,有8mol e-通过质子交换膜
C.b电极的电极反应式为:O2+4e-+4H+=2H2O
D.催化剂电极采用疏松多孔结构可提高电极反应效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6![]() C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:
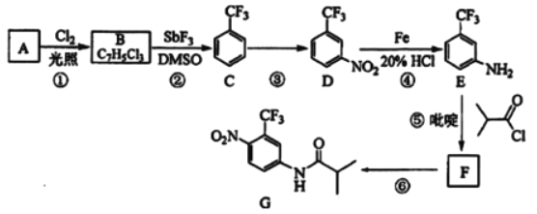
回答下列问题:
(1)A的结构简式为__。C的化学名称是__。
(2)③的反应试剂和反应条件分别是__,该反应的类型是__。
(3)⑤的反应方程式为__。吡啶是一种有机碱,其作用是__。
(4)G的分子式为__。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__种。
(6)4甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:

已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32-,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol![]() 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol![]() H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com