
控制变量法是研究化学变化规侓的重要思想方法。请仔细观察
下表中50 mL稀盐酸和1g碳酸钙反应的实验数据:w.w.w.k.s.5.u.c.o.mwww..com
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol·L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
科目:高中化学 来源: 题型:
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| 2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| 4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| 5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| 7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| 8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| 9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| 10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
①写出该反应的化学方程式:___________________________________________________;
②上述反应中生成0.1 mol还原产物时,转移电子的物质的量是_________________mol;
③由单质与氧气反应生成
(2)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4![]() Na2SO4+S↓+SO2↑+H2O)。
Na2SO4+S↓+SO2↑+H2O)。
烧杯编号 | 加3%Na2S2O3溶液体积(mL) | 加H2O体积(mL) | 加(体积比为1∶20)H2SO4溶液体积(mL) | 所需时间(s) |
1 | 5 | 5 | 2 |
|
2 | 7 | 3 | 2 |
|
3 | 10 | 0 | 2 |
|
在三个烧杯(底部有黑色“+”字标记)内分别加入表中所示体积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“+”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是_________________,因变量是_________________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:
__________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省高三五校联谊模拟考试(理综)化学部分 题型:选择题
控制变量法在化学实验探究中运用较多,它是指在研究和解决问题的过程中,对影响事物变化规律的因素或条件加以人为控制,使其中的一些条件按照特定的要求发生或不发生变化,以便在研究过程中,找到事物变化发展的规律。根据因素和条件的性质,可分为实验变量(自变量)、反应变量(因变量)和无关变量。某研究小组用酸性KMnO4溶液与H2C2O4溶液反应中溶液紫色消失的方法,来研究浓度对化学反应速率的影响。下列实验有关变量控制的操作错误的是 ( )
A.为控制无关变量的影响,将实验温度均确定为25°C、酸性KMnO4溶液与H2C2O4溶液的体积均确定为4mL,不使用催化剂
B.可选择浓度分别为0. 05mol/L、0. 01mol/L、0. OO1mol/L的KMnO4酸性溶液和浓度均为0. OO1mol/L的H2C2O4溶液反应,来操纵实验变量,进行对照实验
C.可将单位时间内反应所生成的CO2体积作为实验变量(自变量)进行本实验研究
D.该实验研究中的反应变量(因变量)是溶液紫色褪去所消耗的时间
查看答案和解析>>
科目:高中化学 来源:期末题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
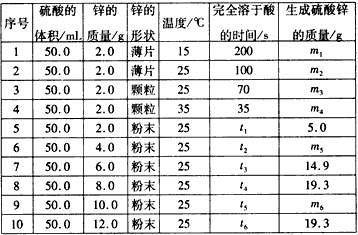
(12分)控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/ ℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
分析以下数据,回答下列问题:
(1)实验1和实验2表明,______________对反应速率有影响,对同一规律进行研究的实验还有一组是______________________(填实验序号)。
(2)下列说法正确的是_______
A.t1<70 B. m1<m2 C. m6=19.3 D. t1>t4
(3)本实验还可以研究___________________________对化学反应速率的影响。
(4)硫酸的物质的量浓度是______mol/L, 实验6生成的硫酸锌的质量m5=________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com