
| A. | C2H4、C2H2、CO2 | B. | CH4、CHCl3、CO2 | C. | Cl2、H2、N2 | D. | NH3、H2O、CO2 |
分析 同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性键,由极性键构成的分子,结构对称,正负电荷的中心重合,则为非极性分子.
解答 解:A.C2H4中有C、H元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子;C2H2中有C、H元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子;CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子,故A正确;
B.CH4 中含有极性键,为正四面体结构,结构对称,分子中正负电荷重心重叠,为非极性分子;CHCl3有C、H和C、O元素之间形成极性键;但结构不对称,正负电荷的中心不重合,属于极性分子;CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子,故B错误;
C.Cl2中只有Cl-Cl非极性键,属于非极性分子;H2中只有H-H非极性键,属于非极性分子;N2中只有N-N非极性键,属于非极性分子,故C错误;
D.NH3中有N、H元素形成的极性键,但结构不对称,属于极性分子;H2O中H、O元素形成的极性键,但结构不对称,属于极性分子;CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子,故D错误;
故选A.
点评 本题考查化学键及分子的极性,明确化学键判断的方法及分子极性的判断方法是解答本题的关键,应熟悉常见分子的构型,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热的方法可除去KNO3溶液中混有的FeCl3 | |
| D. | Na2CO3溶液加水稀释后,恢复至室温,pH和Kw均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: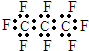 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 一个全氟丙烷分子中有10个共用电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别将它们配制成溶液,再加入澄清石灰水,观察是否有沉淀产生 | |
| B. | 分别将它们配制成溶液,再进行焰色反应,观察火焰颜色 | |
| C. | 分别将它们配制成溶液,再加入BaCl2溶液,观察是否有沉淀产生 | |
| D. | 分别加热,再用澄清石灰水检验是否有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHC03固体 | Na2C03固体 | / | 加热 |
| B | Al2O3 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com