
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
B. 等浓度等体积的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为: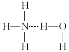
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:(已知:NH4++OH-![]() NH3↑+H2O)
NH3↑+H2O)
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到0.08mol气体;
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?________(答是或否)
(2)由第二份进行的实验得知混合物中应含有_____(填离子符号),其物质的量浓度为______。
(3)由第三份进行的实验可知12.54g沉淀的成分为________。
(4)综合上述实验,你认为以下结论正确的是_________。
A.该混合液中一定有K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K)≥0.04mol
B.该混合液中一定有NH4+、CO32-、SO42-,可能含有K+、Cl-
C.该混合液中一定有NH4+、CO32-、SO42-,可能含有Mg2+、K+、Cl-
D.该混合液中一定有NH4+、SO42-,可能含有Mg2+、K+、Cl-
(5)我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4=K2SO4+I2+H2O
①配平该方程式,并且用单线桥法表示该方程式电子转移的方向和数目:________。
②该反应中氧化剂和还原剂的物质的量之比为_____________。
③如果反应中转移0.5mol电子,则生成I2的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:

(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸丙二酯(PTT)是一种性能优异的新型聚酯纤维材料和热塑性聚酯材料,是当前国际上最新开发的热门高分子新材料。PTT的一种合成路线如图所示。
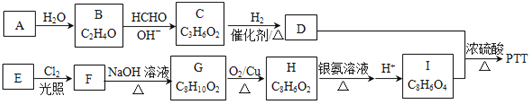
已知: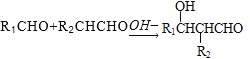
试回答下列问题:
(1)已知A→B是加成反应,A的分子式为________,C中含有的官能团是_________(填名称)。
(2)有机物D的名称为_______________________。(用系统命名法命名)
(3)芳香烃E的一氯代物只有2种,则E的结构简式______________。
(4)由D与I合成PTT的化学方程式为______________,该反应的反应类型为____________。
(5)有机物G的同分异构体有很多种,同时符合下列条件的同分异构体有________种。
①能与FeCl3溶液发生显色反应 ②苯环上只有三个取代基 ③分子中含有两个—OH。
其中核磁共振氢谱显示有5组峰,且峰面积之比为3∶2∶ 2∶ 2∶ 1的是__________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 被广泛用于食品调味剂,其某种合成路线如下所示。
被广泛用于食品调味剂,其某种合成路线如下所示。
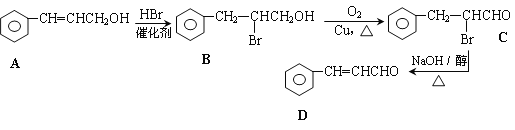
回答如下问题:
(1)B中的官能团名称为_______________
(2)C生成D的反应类型为_____________
(3)在以上路线中,HBr的作用是__________________________________________________
(4) ![]() ,从甲醛、乙醛、丙醛中选择原料(无机原料任选),仿照上述合成路线,写出分两步合成C(CH2OH)4的合成路线_____________________________________________________________
,从甲醛、乙醛、丙醛中选择原料(无机原料任选),仿照上述合成路线,写出分两步合成C(CH2OH)4的合成路线_____________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com