
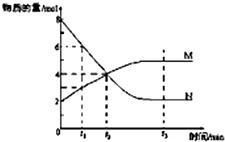
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:分析 (1)M物质的量增大、N的物质的量减小,故N为反应物、M为生成物,最终N的物质的量不变且不为0,则该反应属于可逆反应,根据物质的量之比等于化学计量数之比确定化学计量数,进而书写反应方程式;
(2)可以反应到达平衡状态时,正、逆速率相等,各组分的物质的量不变;
(3)某一时间反应中各物质的物质的量是否变化判断反应是否达到平衡;
(4)①根据v=$\frac{△c}{△t}$求出v(SO2),再利用速率之比等于化学计量数之比,计算v(O2);
②根据方程式,计算出SO3的物质的量,再利用c=$\frac{n}{V}$计算SO3的物质的量浓度.
解答 解:(1)M物质的量增大、N的物质的量减小,故N为反应物、M为生成物,最终N的物质的量不变且不为0,则该反应属于可逆反应,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,则N、M的化学计量数之比为2:1,故反应方程式为:2N?M,
故答案为:2N?M;
(2)在t3时刻M、N的物质的量为定值,处于平衡状态,故在t3时刻v正=v逆,
故答案为:t3;
(3)由图可知t2时,反应没有达到平衡,此时反应继续向正方向移动,正反应速率大于逆反应速率,
故答案为:>;
(4)①以SO2表示的该反应的速率v(SO2)=$\frac{\frac{(7-3)mol}{4L}}{4s}$=0.25mol•L-1•s-1,速率之比等于化学计量数之比,所以有:
v(O2)=$\frac{1}{2}$v(SO2)=$\frac{1}{2}$×0.25mol•L-1•s-1=0.125mol•(L-1•s-1),
故答案为:0.125mol•L-1•s-1
(2)参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)?2SO3(g)可知,生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为c(SO3)=$\frac{4mol}{4L}$=1mol/L.
故答案为:0.125mol•(L-1•s-1);1molL-1.
点评 本题考查化学反应速率与化学平衡知识,做题时注意从反应物和生成物的物质的量的变化角度,判断反应物和生成物以及反应是否达到平衡,题目难度一般.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 水蒸气含有的分子数为1NA | |
| B. | 常温常压下,32 g O2含有的原子数为2个 | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4 L | |
| D. | 体积为1L、物质的量浓度为0.5 mol/L的氯化钙溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 1:2:12:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示: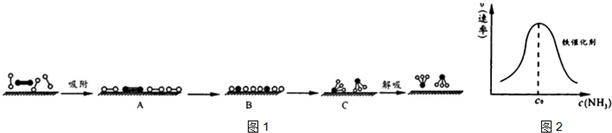
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 | |
| C. | 上述实验采用相同指示剂,可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子易与钛离子形成可溶性难电离物质 | |
| B. | 氢氟酸的氧化性比其他酸强 | |
| C. | 氢氟酸的还原性比其他酸强 | |
| D. | 氢氟酸的酸性比其他酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA | |
| C. | 78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA | |
| D. | 标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com