
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(带解析) 题型:单选题
分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
查看答案和解析>>
科目:高中化学 来源:2013届天津市十二校高三第二次模拟联考化学试卷(带解析) 题型:实验题
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。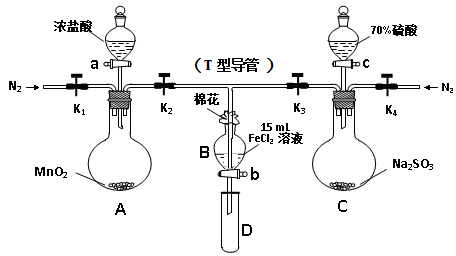
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中, 继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A。
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3。
Ⅵ.更新试管D,重复过程Ⅳ。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)能说明氧化性Fe3+ > SO2的离子方程式是 。
(5)过程Ⅵ,检验B溶液中是否含有SO42-的操作是 。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果不能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”),请用必要的文字说明理由 。
| | 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有 Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有SO42- |
 FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
查看答案和解析>>
科目:高中化学 来源:2015届福建省等五校高二上学期期中考试化学试卷(解析版) 题型:选择题
分别放置下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
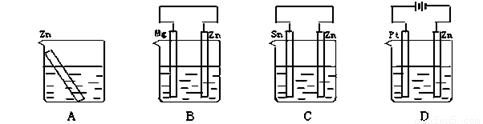
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com