
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2 mol H3 AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2和11.2 L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.无法确定
(1)1∶1
(2)As2S3 氢氧化钠溶液(或硫酸铜溶液)
(3)10 mol 正极
(4)a
【解析】(1)As在As2S3中的化合价为+3,在As4S4中的化合价为+2,每摩As2S3转化为As4S4时得到2 mol e-,而每摩SnCl2转化为SnCl4时失去2 mol e-,故二者在反应时物质的量之比为1∶1。(2)H2S既可与NaOH溶液反应,又能与CuSO4溶液反应。(3)当生成2 mol H3AsO4时,同时生成了3 mol S,二者共失去电子10 mol。HNO3在反应中作氧化剂,在正极上发生反应,所以NO2应在正极上生成。(4)根据反应4NO2+O2+2H2O=4HNO3可知,反应共生成2 mol HNO3,浓HNO3与碳反应时的物质的量之比为4∶1,所以2 mol HNO3如完全反应可生成CO2 0.5 mol。但由于硝酸的浓度降低到一定程度时,碳就不再与硝酸反应,所以实际产生CO2的物质的量应小于0.5 mol。


科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-2练习卷(解析版) 题型:填空题
实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无
色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如下表。
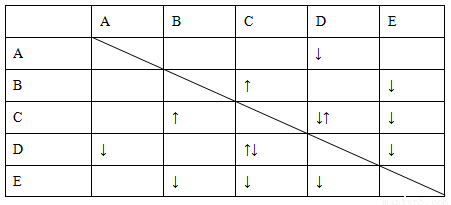
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:________。
(3)C、D两溶液反应的离子方程式为________。
(4)向含有0.1 mol溶液的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-2练习卷(解析版) 题型:填空题
根据下面物质间转化的框图,回答有关问题;
`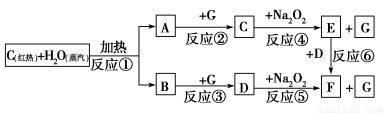
(1)由反应①产生的A、B混合物的工业名称是________。
(2)写出框图中D、E的化学式:D________;E________。
(3)如果2 mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是________L,同时反应中转移电子总数是____________。(NA表示阿伏加德罗常数)
(4)如果A、B混合气体7.8 g,在与G充分反应后,通过足量Na2O2层,可使Na2O2增重________g。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:选择题
某无色溶液中含有K+、Cl-、OH-、SO32—、SO42—,为了检验除OH-外的其他所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象。
下列有关结论错误的是( )

A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl
B.现象3中白色沉淀是BaSO4
C.产生现象2的离子方程式是Br2+2H2O+SO2=4H++2Br-+SO42—
D.试剂②是盐酸,试剂③是硝酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-1练习卷(解析版) 题型:选择题
我们学习化学很重要的一个方面就是解决生活中的实际问题,下列家庭小实验不合理的是( )
A.用灼烧并闻气味的方法检验真皮衣料
B.用淀粉和水检验食盐中的碘元素
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用食醋除去热水壶中的水垢
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习2-3-2氧化还原反应方程式配平及计算练习卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是 ( )。
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO4-…… | Cl2、Mn2+…… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型四 离子反应型专题练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定的溶液中可能大量共存的是( )
A.无色透明溶液中:Al3+、Ca2+、Cl-、HCO3-
B.含大量Fe3+的溶液中:K+、I-、SO42-、NO3-
C.与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F-
D.由水电离出的c(H+)=1.0×10-14 mol·L-1的溶液中:Mg2+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型十四 定量计算型专题练习卷(解析版) 题型:选择题
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
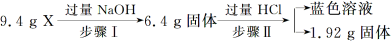
下列有关说法正确的是( )
A.步骤Ⅰ中减少的3 g固体一定是混合物
B.步骤Ⅱ中质量减少的物质一定是Cu
C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学 题型十三 表格实验型专题练习卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是( )
实验操作现象解释或结论
A向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液出现白色沉淀溶液X中一定含有SO42-
B等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体HA放出的氢气多且反应速率快 HB酸性比HA强
C在镁、铝为电极,氢氧化钠为电解质的原电池装置中镁表面有气泡金属活动性:Al>Mg
D向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热未出现砖红色沉淀 Y中不含有醛基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com